NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请完成下列问题:
(1)NO对环境的危害在于_______(填以下项的编号)。()
| A.破坏臭氧层 |
| B.高温下能使一些金属被氧化 |
| C.造成酸雨 |
| D.与人体血红蛋白结合 |
(2)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式_____________________。
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50 ℃,发现气体的压力迅速下降,压力降至略小于原压力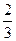 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式______________________。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式______________________。
(4)解释变化(3)中为什么最后的气体总压力小于原压力的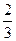 。
。