钨是重要的战略元素,钨可以制造枪械、火箭推进器的喷嘴、切削金属,是一种用途较广的金属。工业上从经过预处理的钨矿原料(主要成分是FeWO4、MnWO4还含有Si、P、As的化合物等)制备WO4,然后通过煅烧还原三氧化钨生产钨粉。其中生产WO3的流程如下:同答下列问题:

(1)上述流程中,操作甲的名称是_____________________________________________。
(2)pH=10的溶液中含有的杂质阴离子有SiO32-、HAsO32-、HAsO42-、HPO42-等。加入H2O2的目的是_______,其离子方程式为:___________________________________________。
(3)钨矿原料“碱分解”时的浸出率与原料中的CaO含量、NaOH浓度、碱用量等都有关系,如下表所示。钨矿原料碱分解时的浸出率受NaOH浓度等因素影响的关系表

注:碱用量的单位为理论量的倍数
下列说法正确的是
| A.增大NaOH浓度,浸出率增大 |
B.增大碱用量,浸出率一定增大 |
| C.增大碱用量,浸出率一定减小 |
D.原料中CaO的含量增大,则浸出率增大 |
(4)在“净化”阶段,加入MgCl2的目的是使混合溶液中的其余酸根离子沉淀下来。此时尽量使溶液pH=10,以免产生Mg(OH)2沉淀,溶液中c(Mg2+ )应不超过_______(Ksp[Mg(OH)2]=5.6×10-12)。

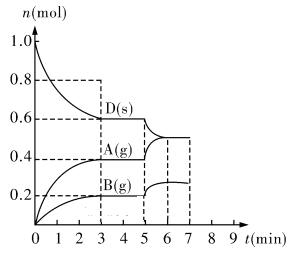
 2Z(g)、②2M(g)
2Z(g)、②2M(g)


 CH3OH(g),6秒末时容器内压强为开始时的0.6倍,
CH3OH(g),6秒末时容器内压强为开始时的0.6倍, 粤公网安备 44130202000953号
粤公网安备 44130202000953号