利用零价铁(ZVI)处理水体砷污染的原理为:零价铁被氧化腐蚀得到水合氧化铁,[Fe(OH)3和 FeOOH,可分别写为Fe2O3•3H2O和Fe2O3•H2O统称水和氧化铁],水合氧化铁再吸附沉降砷的化合物(如:含AsO43 -、AsO33 -等物质)。
(1)写出单质铁在水体中被(O2)氧化腐蚀得到水和氧化铁(FeOOH)的化学方程式:。
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响零价铁去除水体中砷的效率的因素提出以下假设,并进行了实验探究:
假设1:;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2:
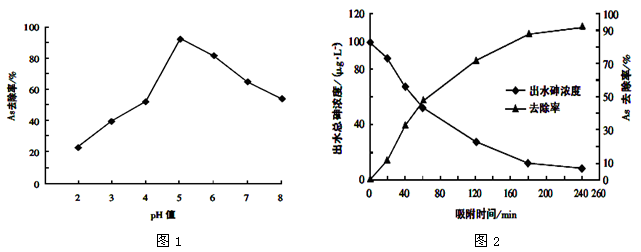
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是_____________;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?_______。(填“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验。请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)
实验步骤
|
预期实验结果和结论
|
①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间_________,以减少水中的溶解氧;
|
___________________,则溶解氧对砷的去除效率有影响;反之则无影响。
|
②___________________________________
______________________________________
|
③___________________________________
______________________________________
|
 CH3OH(g),6秒末时容器内压强为开始时的0.6倍,
CH3OH(g),6秒末时容器内压强为开始时的0.6倍, CH3OH(g),6秒末时容器内压强为开始时的0.6倍,
CH3OH(g),6秒末时容器内压强为开始时的0.6倍,