A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4︰1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2︰1的离子化合物丙。
⑴ D的原子结构示意图为 ,B单质的电子式为 ,E在周期表中的位置为 ;
⑵ 下列说法正确的有 ;
a.化合物乙为正四面体形分子,是由极性键构成的非极性分子
b.C、D、E、F原子半径由大到小的顺序为 C > D > E > F
c.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
d.化合物甲和化合物丙都含有离子键和共价键
⑶ 将F在空气中完全燃烧的产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应:
;
⑷ 写出一个由以上元素构成的10 e- 微粒与18 e- 微粒反应的离子方程式:
;
⑸ 在1 mol·L-1甲溶液中,下列关系式正确的是 ;
a.c(NO3-) > c(NH4+) > c(H+) > c(OH-)
b.c(NH4+) > c(NO3-) > c(H+) > c(OH-)
c.c(NO3-) = c(NH4+) > c(H+) = c(OH-)
d.c(NH4+) = c(NO3-) > c(H+) > c(OH-)
⑹ 25 ℃时,丙的水溶液的pH大于7,其原因是(用离子方程式解释):
。

 Ⅴ
Ⅴ  Ⅱ
Ⅱ
 试根据下列6种有机物之间的转化关系,回答有关问题:
试根据下列6种有机物之间的转化关系,回答有关问题:
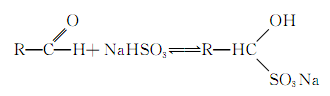
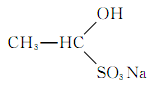 水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号