醛可以跟亚硫酸氢钠的饱和溶液发生加成反应,生成物是水溶性的α羟基磺酸钠: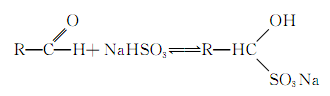
反应是可逆的,在通常条件下有70%~90%向正反应方向转化。
(1)若溴苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用的试剂是__________________,其分离方法为__________________。
(2)若在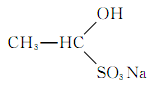 水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
醛可以跟亚硫酸氢钠的饱和溶液发生加成反应,生成物是水溶性的α羟基磺酸钠: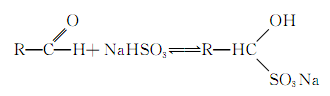
反应是可逆的,在通常条件下有70%~90%向正反应方向转化。
(1)若溴苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用的试剂是__________________,其分离方法为__________________。
(2)若在 水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。