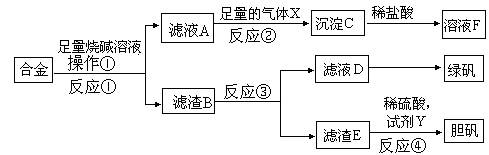
用18 mol/L浓硫酸配制100ml 3.0mol/L稀硫酸实验步骤如下:①计算所用硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是_________ml;
(2)所需要的仪器有:容量瓶(规格:__________)、量筒(规格:__________)
(从下列中选用填序号:A、10ml B、25ml C、500ml D、250ml E、100ml),
除此之外还需要的仪器有:____________________________________________________。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、所用的溶解仪器未洗涤_________________;
B、容量瓶用蒸馏水洗涤后未干燥_________________;
C、所用的浓硫酸长时间放置在敞口容器内_________________;
D、定容时仰视溶液的凹液面_________________;
E、溶解后立即转移到容量瓶中定容_________________。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.2
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。