氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为 。 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为 。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为 。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 |
△H(kJ/mol) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式 。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式 。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是 。
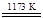 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg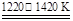 Ti+2MgCl2
Ti+2MgCl2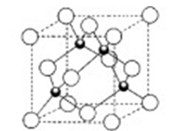


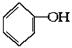 合成
合成 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去) D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
 B.
B. C.
C.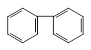 D.
D.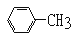
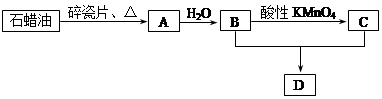
 粤公网安备 44130202000953号
粤公网安备 44130202000953号