已知:(X代表卤素原子,R代表烃基)

利用上述信息,从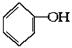 合成
合成 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B________ _、D_____ ____。
(2)反应①~⑦中属于消去反应的是 。(填数字代号)
(3)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
已知:(X代表卤素原子,R代表烃基)

利用上述信息,从 合成
合成 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B________ _、D_____ ____。
(2)反应①~⑦中属于消去反应的是 。(填数字代号)
(3)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)