作为重要的工业三酸之一,硝酸通常有以下两种制取方法:
I.硝酸盐与浓硫酸反应: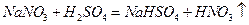
II.氨的催化氧化法,其主要步骤为:①氨的催化氧化;②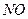 氧化成
氧化成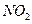 ;③水吸收
;③水吸收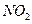
生成硝酸。
(1)方法l中不能加强热,其原因是 。(2)写出方法Ⅱ中步骤①的化学反应方程式 。(3)采用方法Ⅱ制取硝酸,若经过多次循环后,步骤②、③中氮元素的总利用率是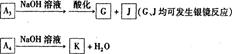
90%,某化工厂用1 t氨气制得5t63%的硝酸溶液,求步骤①中氨气的转化率?(书写计算过程,结果精确到0.1%)
作为重要的工业三酸之一,硝酸通常有以下两种制取方法:
I.硝酸盐与浓硫酸反应: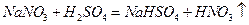
II.氨的催化氧化法,其主要步骤为:①氨的催化氧化;②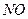 氧化成
氧化成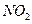 ;③水吸收
;③水吸收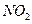
生成硝酸。
(1)方法l中不能加强热,其原因是 。(2)写出方法Ⅱ中步骤①的化学反应方程式 。(3)采用方法Ⅱ制取硝酸,若经过多次循环后,步骤②、③中氮元素的总利用率是
90%,某化工厂用1 t氨气制得5t63%的硝酸溶液,求步骤①中氨气的转化率?(书写计算过程,结果精确到0.1%)