山东省枣庄市高三4月模拟考试(理综)化学部分
下列说法错误的是 ( )
| A.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B.含有磷元素的生活污水排人江河易引起水体富营养化,造成藻类过度繁殖影响水质导致环境污染 |
| C.“食用色素”、“碘元素”、“亚硝酸盐”在某些食品添加剂中允许含有,但符合限量是不会引起中毒的 |
| D.实行“汽车下乡”政策、大力推广使用家用小轿车不利于节能减排 |
对于某一化学事实,下列表述错误的是 ( )
| A.在加入铝粉能放出氢气的溶液中K+、NH4+、CO32—、C1—可能大量共存 |
| B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,能发生“先沉淀后溶解”现象 |
| C.向饱和碳酸钠溶液中通入过量CO2的离子方程式为: 2Na++CO32—+CO2+H2O |
| D.0.1mol·L—1乙酸溶液的pH约为3,可证明它是弱电解质 |
根据表中部分短周期元素的原子半径和主要化合价信息,判断以下叙述正确的是 ( )
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.154 |
0.118 |
0.099 |
0.102 |
0.073 |
| 主要化合价 |
+1 |
+3 |
+7、—1 |
+6、—2 |
—2 |
A.氢化物的沸点为:H2T<H2R
B.L和Q形成的化合物中,两种微粒最外层均达到8电子稳定结构
C.单质的还原性顺序:L<M
D.稳定简单离子半径的大小顺序为:L>T>R
明治维新期间日本拟定征服世界的步骤是:第一期征服台湾,第二期征服朝鲜,第三期征服满蒙,第四期征服“支那”,第五期征服世界。日本为实现第三期目标采取的行动是( )
| A.中日甲午战争 | B.八国联军侵华战争 |
| C.九一八事变 | D.卢沟桥事变 |
一定条件下,在体积固定的密闭容器中,一氧化碳与氢气生成甲醇的反应如下: 
CO(g) +2H2(g) 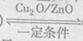 CH3OH (g)
CH3OH (g)
下列说法正确的是 ( )
| A.在其他条件不变的情况下,对处于E点的体系 体积压缩到原来的一半,氢气的浓度减少 |
| B.催化剂的存在使一氧化碳与氢气更大限度的 转化生成甲醇 |
| C.用CO表示的反应速率v(CO)D <v(CO)C |
D.反应达到平衡时,平衡常数表达式为 |
下列说法正确的是( )
| A.配制硫酸亚铁溶液时,常向溶液加入少量稀硝酸和少量铁粉 |
| B.用25.00 mL碱式滴定管量取20.00 mL酸性高锰酸钾溶液 |
| C.用pH试纸检验气体的酸碱性时,一定要先用蒸馏水湿润 |
| D.可以用酒精萃取碘水中的碘单质 |
某温度下,向一定物质的量浓度的盐酸和醋酸中分别加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。根据图判断下列说法正确的是( )
| A.曲线Ⅱ为醋酸稀释时的变化曲线 |
| B.a、b、c三点溶液的pH大小顺序为a>b>c |
| C.a点的Kw值比b点的Kw值大 |
| D.b点水电离的H+物质的量浓度小于c点水电离的H+物质的量浓度 |
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)= 。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度 ( 填“大于”、“等于”或“小于”)氨水中水的电离程度。
填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”、“向右”或“不”)。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
 T/s T/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
⑤.00 |
3.50 |
2.42 |
则500s内N2O5的分解速度v(N2O5)= ;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g) NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2 2N2+6H2O。你认为电解质溶液应显 (填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式 。
水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。
(填序号)。
a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
1 molNH4+全部被氧化成NO3-的热化学方程式为 。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+ 2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为 ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43- MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是 。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
请回答下列问题:
(1)操作l所用到的玻璃仪器的名称是 。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式 。
(4)请你写出验证溶液l中有NH4+的实验过程 。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请你按气流由左到右方向连接下列各装置,顺序为:A→ 。
②检验装置A气密性的方法是 。
③在点燃B处的酒精灯前,应进行的操作是 。
④装置C的作用是 。
工业上合成氨在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g) △H=-92.44 kJ/mol。其部分工艺流程如下图所示:
2NH3(g) △H=-92.44 kJ/mol。其部分工艺流程如下图所示:
(1)合成氨所需要的原料气中,氮气取自 ,氢气来源于 。
(2)对原料气进行净化处理的目的是 。
(3)设备A的名称是 ,设备B的名称是 。
(4)在20~50 Mpa时,工业合成氨选择在400—500℃的温度进行反应,
主要原因是 。
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分别通人一个加热到570℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。则:阳极反应为  ,阴极反应为 。
,阴极反应为 。
Al和Ga及N和As分别是同主族的元素,请回答下列问题:
(1)砷化镓是一种半导体材料,其化学式为 。
(2)写出As原子处于基态时的核外电子排布式 。
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与 个氮原子相连,氮化铝晶体属于 晶体。
(4)NH3是氮的氢化物,中心原子的杂化方式是 ,存在化学键的类型是 ,NH3的沸点比AsH3高的原因是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号