2011年人教版初三上学期第三次月考化学卷
请回忆你学习过的"质量守恒定律"的实验探究,并按要求完成实验方案一和实验方案二。(下表中"实验结论"选填"="、">"、"<"符号)
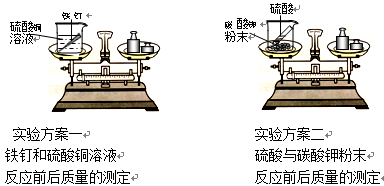
将两个实验结果进行讨论对比时,有同学分析:有一个方案观察到天平不平衡,是因为,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是。
小刚用实验方法区别稀硫酸和氢氧化钠溶液(记作A、B)。
(1)他取适量A、B两种溶液于两支试管中,分别加人适量Na2CO3,溶液,观察到A溶液中产生无色气泡,则A是_______,发生反应的化学方程式为_____________________;
(2)他另取适量A、B两种溶液于两支试管中,分别加入适量CuSO4溶液,B溶液中的现象是____________________________;
(3)他还用了下列试剂中的一种区别A、B两种溶液,该试剂是_______。
I.氯化钠溶液 Ⅱ.硫酸钠溶液 Ⅲ.酚酞试液 Ⅳ.硝酸钠溶液
右图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物省略)。
请按下列要求填空:
(1)物质a主要成分的化学式是__________ ;
(2)物质b主要成分中阳离子是________;
(3)物质c(C6H12O6)所属类别是________该物质中C、H、O三种元素的质量比是________;
(4)写出由CO2生成物质d的化学反应方程式________________________________
(5)标出物质e化学式中带点元素的化合价______。
某科技活动小组为了制取SO2,查阅资料发现,产生SO2的途径很多。在老师指导下,他们根据实验室条件,选取足量锌与适量的浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。反应一段时间后,老师指出还可能生成另一种气体。同学们都很好奇,这是什么气体呢?请你根据锌的化学性质,推断此气体可能是_____,其理由是_________________________。通过该实验,你对物质变化规律,会有什么新的认识?你的观点是_______________。
向盛有酚酞和NaOH溶液的烧杯中滴加稀硫酸,直至液体呈无色。为探究反应后溶液中溶质的组成,所选试剂不正确的是
| A.稀盐酸 | B.锌粒 | C.碳酸钠溶液 | D.紫色石蕊溶液 |
(1)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的_____就能将它们一次性鉴别出来;
(2)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应。实验结束后,该同学发现废液缸中有蓝色沉淀和无色溶液。请你判断无色溶液中的溶质是_____。
下表列出生活中一些液体的PH:
| 液体 |
雨水 |
蒸馏水 |
厨房清洁剂 |
厕所清洁剂 |
| PH |
5.6 |
7 |
12.5 |
1.6 |
⑴上述液体中,酸性最强的是_______,能使酚酞试液变红的是_______;
⑵正常雨水的PH约为5.6,其原因是_____________________;
⑶在厨房清洁剂中加入蒸馏水,厨房清洁剂的PH(填“变大”、“变小”或“不变”) _______;
⑷厨房清洁剂与厕所清洁剂不能混合使用,其原因是_________________________________。
现有粗铜粉末,其中含有少量的铁、锌和金。某活动小组想要测定其中铜的质量分数,设计以下实验方案:
步骤Ⅰ:称取一定质量的粗铜样品,加入过量的稀盐酸充分反应,过滤,将滤渣洗涤、干燥后称量;
步骤Ⅱ:去“步骤Ⅰ”中所得滤渣在空气中充分灼烧,冷却到室温后称量;
步骤Ⅲ:根据测得数据推算出粗铜中铜的质量分数。
⑴步骤Ⅰ:验证稀盐酸过量的方法是_________;如果不对滤渣进行洗涤而直接干燥,称量结果将会(填“偏高”或“偏低”)。
⑵“步骤Ⅱ”中反应的化学方程式为___________________;
⑶某同学认为,按以上方案完成“步骤Ⅰ”,在进行“步骤Ⅱ”时,将所得滤渣在空气中充分灼烧后,再补充适当操作,也可以推算出粗铜中铜的质量分数。写出补充的操作。
某工厂在生产过程中产生甲、乙两种废水。甲废水中主要含有硫酸和硫酸镁;乙废水中主要含有氢氧化钠(其他成分含量很少,可忽略)。为了研究废水处理方案,某活动小组取来一定量该工厂的甲、乙两种废水,在实验室里进行模拟实验。要求不外加其他试剂,使处理后的废水呈中性并回收得到硫酸镁固体。写出实验步骤。
提示:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
下列四个图像能正确反映其对应实验操作的是( )
| A.高温煅烧一定质量的石灰石 |
| B.用相等质量的双氧水分别制取氧气 |
| C.向一定体积的氧氧化钠溶液中加入足量的稀盐酸 |
| D.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 |
某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应)。试计算:
(1)用40%的浓硫酸(密度为1.30 g/cm3)l0mL配制2%的稀硫酸,需加水(密度为1.0 g/cm3)多少毫升?
(2)向盛有20 g废水的锥形瓶中逐滴滴加2%的稀硫酸,至恰好完全反应。将实验所得数据绘制成右图所示图象。求废水中氢氧化钾的质量分数?
本学期,同学们在准备实验操作考查实验过程中,有如下猜想。你认为不正确的有( )
| A.在鸡蛋壳中加入稀HCl,如产生的气体通入澄清石灰水后有浑浊现象,可证明蛋壳中含有CO32- |
| B.不同颜色花瓣的浸出液遇碱溶液一定变蓝色 |
| C.花瓣中的有机色素分子更容易分散于酒精的微粒之中 |
| D.在同一温度下,有机色素在酒精中的溶解度小于在水中的溶解度 |
化学就在我们身边,它能改善我们的生活,请从“
| A.氧气 | B.氮气 | C.生石灰 | D.熟石灰E、食醋 F、干冰 G、不锈钢 H、天然气”中选择适当的物质填空(填编号) |
⑴抢救危重病人常用的物质____________;⑵可作燃料的是____________;⑶常用作袋装食品干燥剂的是____________;⑷厨房调味品中pH小于7的是__________。
酸、碱、盐溶解性表是学习化学的重要工具。下表列出了部分酸、碱、盐在20℃时的溶解性。利用此表完成下列各小题:
| 离子 |
OH- |
Cl- |
SO42- |
| H+ |
|
溶、挥 |
溶 |
| Na+ |
溶 |
溶 |
溶 |
| Ca2+ |
微 |
溶 |
微 |
| Ba2+ |
溶 |
溶 |
不 |
(1)查:CaSO4的溶解性______;
(2)写出表中空格处物质的化学式______;
(3)从表中选择,写出一个生成不溶物且属于中和反应的化学方程式_________________。
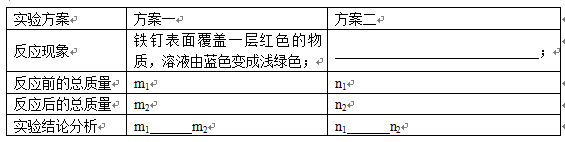
已知:A、B、C、D、E、F六种物质是初中化学常见的物质。A、B是单质,C、D、E都是氧化物。A、B、C转化为F的过程较为复杂,F的成份也较复杂,其主要成分是一种红色的固体。试根据各物质间的转化关系完成下列各题。(题中除反应条件未给出外,反应物和产物均已给出。)
(1)写出F中主要成分的化学式:__________________。
(2)写出下列物质转化的化学方程式:
E→B+C:______________________________;
A+B→D:______________________________;
小勇在化学晚会上观看了“瓶吞鸡蛋”的魔术(如下图1),看到鸡蛋被吞进瓶内。该反应的化学方程式是________________________。
小勇思考:瓶能吞蛋,能不能吐蛋呢?他进行了如上图2的实验,结果鸡蛋吐了出来。他加入的试剂P是_____(写溶液名称),吐蛋的原理是____________________________________。
推理是一种重要的研究和学习方法。下列推理正确的是( )
| A.碱中都含有氢氧根,所以碱中一定含有氢元素 |
| B.分子是构成物质的微粒,因此物质都是由分子构成的 |
| C.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应 |
| D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中燃烧 |
A~H是初中化学常见的物质,A和C的组成元素相同、在常温下均为液体,B为单质,D为常见的碱,E为一种常见的建筑材料。它们的相互转化关系如图13所示(反应条件、部分生成物已略去)。

(1)C的化学式为______。
(2)E中金属元素的化合价为______价。
(3)反应③的化学方程式为________________________。
(4)反应⑤在实际中的应用是________________________。
淀粉溶液遇碘变蓝色。实验表明,无论是固体碘还是碘蒸气,均能使淀粉溶液变蓝色。这一事实说明
| A.分子在不停运动 | B.分子间有一定的间隔 |
| C.同种分子性质相同 | D.同种分子运动速度相同 |
下列关于原子的说法正确的是
| A.原子是一定比分子小的基本粒子 | B.原子是一切变化中的最小粒子 |
| C.原子是不能再分的粒子 | D.原子的质量约等于原子核内质子和中子的质量之和 |
我国淡水资源非常缺乏,生活中要注意节约用水,保护水资源。下列观点正确的是
| A.控制水中所有动植物的生长 | B.废水只要变成无色透明就可以直接排放 |
| C.大量开采地下水以满足社会对水的需求 | D.设法提高工业用水的重复利用率 |
达菲(化学式为C16H28N2O4·H3PO4)是世界卫生组织推荐的抗禽流感药物。下列有关的说法正确的是
| A.达菲属于氧化物 |
| B.达菲由碳、氢、氮、氧、磷五种元素组成 |
| C.达菲分子中碳、氮、磷元素的质量比为16∶2∶1 |
| D.达菲分子由碳原子、氢原子、四氧化二氮分子和磷酸分子构成 |
下列含氯物质的化学式中,氯元素的化合价最低的是
| A.用于漂白杀菌的次氯酸钠(NaCl0) | B.用于鱼塘的增氧剂(C102) |
| C.用来调味的食盐(NaCl) | D.氯酸钾(KClO3) |
对于化学反应方程式S+O2 SO2表示的意义,叙述错误的是
SO2表示的意义,叙述错误的是
| A.在点燃的条件下,硫和氧气生成了二氧化硫 |
| B.硫加氧气反应生成二氧化硫 |
| C.每32份质量的硫和32份质量的氧气完全反应能生成64份质量的二氧化硫 |
| D.在点燃的条件下,每一个硫原子和一个氧分子化合生成一个二氧化硫分子 |
有一条酸河,经分析发现是由于河水中含有的物质R在氧气的作用下发生反应所致,其反应的化学方程式为2R+2H2O+7O2=2FeSO4+2H2SO4,则R的化学式是
| A.FeS | B.Fe2S3 | C.FeO | D.FeS2 |
实验室制取气体选择收集方法时,对气体的下列性质不必考虑的是
| A.颜色 | B.密度 | C.溶解性 | D.是否与水反应 |
在反应2A+B=C+2D中,9.8gA与8gB完全反应生成14.2gC,则下列结论正确的是
A. 生成D1.8g B. A、B、C、D的质量比为49:40:71:18
C. 生成D3.6g D. A、B、C、D的相对分子质量比为2:1:1:2
用下列物质的编号回答有关问题:①雨水 ②蒸馏水 ③雨后洁净的空气 ④四氧化三铁 ⑤氮气 ⑥高锰酸钾分解后的固体产物 ⑦硫在氧气中恰好完全反应的产物 ⑧自来水
其中属于混合物是 ,属于纯净物是 ,
属于单质的是 ,属于化合物的是
下表为元素周期表的部分示意图,横行为“周期”,竖列为“族”请利用下表回答相关问题。
⑴用符号表示:带两个单位负电荷的离子______(写一种),Mg2+的电子排布和_____原子的电子排布完全相同。
⑵由这部分元素周期表你能发现并归纳很多规律,请你模仿例子写出另外两个规律。
例如:在同一个周期中从左向右随着原子序数的增加,原子的最外层电子数也依次递增;
①________________________________________________________;
②________________________________________________________。
⑶图甲是两种元素在周期表中的信息,图乙是氟原子的原子结构示意图。请完成下列问题:
①图甲方框的横线上填的是______,图乙方框横线上的数字是______;
②图甲所示两种元素形成化合物的化学式为____________。
写出或配平下列反应的化学方程式:
(1)铁在氧气中燃烧: ;
(2)硫跟氧气反应: ; (3)用过氧化氢与二氧化锰制氧气: ;
(3)用过氧化氢与二氧化锰制氧气: ;  (4)C2H2 + O2 CO2 + H2O
(4)C2H2 + O2 CO2 + H2O (5)Fe2O3 + H2 Fe + H2O
(5)Fe2O3 + H2 Fe + H2O
(6)FeS2 + O2 Fe2O3+ SO2
下列化学符号:①2CO;②2 Na +;③Mg 2+;④ ;⑤H 2O 中数字“2”表示(均填序号)
;⑤H 2O 中数字“2”表示(均填序号)
(1)离子个数是 ; (2)一个离子所带电荷值是 ;
(3)分子个数是 ; (4)元素的化合价数值是 。
已知在物质的变化或转化过程中,元素的种类是不会发生改变的;二氧化碳中含有碳、氧两种元素,水中含有氢、氧两种元素。某学生为了证明甲烷(天然气的主要成分)中含有碳、氢两种元素,设计并完成了如下实验方案。请你帮他完成下面的实验报告。
实验目的:证明甲烷中含有碳、氢元素
实验用品:火柴、盛有甲烷的贮气瓶、一个光洁干燥的小烧杯、澄清石灰水
| 实验步骤 |
实验现象 |
结论 |
| 1点燃甲烷 2将光洁干燥的小烧杯罩在 甲烷燃烧的火焰上方 |
现象 。 |
证明含有 元素 |
| 3将蘸有 的小烧杯罩在甲烷燃烧的火焰上方 |
现象:烧杯内壁 出现“白膜” |
证明含有 元素 |
以下是小瑛和小方设计的证明分子运动的实验:小方的实验如图(1)所示,图(2)是小瑛的实验,在锥形瓶中的小瓶里装着浓氨水,锥形瓶口用一张滤纸盖住,滤纸刚刚用酚酞溶液浸过。 

(1)小瑛观察到的现象是 ;
小方观察到的现象是 、
他可以得到的结论是 。
(2)小方在大烧杯外放一杯酚酞溶液的目是 。
(3)请你就两位学生的操作过程、药品用量、以及实验的严密性或其它方面作出比较性的评价:
小霖同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小霖查阅资料,记录了下列几种物质的颜色:
| 物 质 |
MgO |
MgCl2 |
Mg3N2 |
Mg(NO3)2 |
MgCO3 |
Mg(OH)2 |
| 颜 色 |
白色 |
白色 |
淡黄色 |
白色 |
白色 |
白色 |
其他同学认为不必查阅氯化镁的颜色,理由是 ;
[提出猜想]分析资料,小霖认为淡黄色固体可能是由镁与空气中的 反应生成的;
[实验探究]小霖设计实验证实了自己的猜想,她的方案可能 ;
[实验结论]根据小霖的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:
、
[反思与评价]通过上述实验,你对燃烧有什么新的认识?





 粤公网安备 44130202000953号
粤公网安备 44130202000953号