2010年高考化学试题分项专题十四 化学计算
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:。
⑵ 煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的化 学方程式为:。
学方程式为:。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 
② 
③ 
总反应: =;
=;
一定条件下的密闭容器中,该总反应达到平衡,要提高的转化率,可以采取的措施是(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加的浓度 e.分离出二甲醚
⑷ 已知反应② 某温度下的平衡常数为400 。此温度下,在密闭容器中加入,反应到某时刻测得各组分的浓度如
某温度下的平衡常数为400 。此温度下,在密闭容器中加入,反应到某时刻测得各组分的浓度如 下:
下:
| 物质 |
|||
| 浓度/() |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:(填">"、"<"或"=")。
② 若加入后,经10 反应达到平衡,此时() =;该时间内反应速率() =。
下列叙述正确的是
| A. | 在醋酸溶液的 ,将此溶液稀释1倍后,溶液的 ,则 |
| B. | 在滴有酚酞溶液的氨水里,加入 至溶液恰好无色,则此时溶液的 |
| C. | 盐酸的 , 盐酸的 |
| D. | 若 的盐酸与 溶液混合后,溶液的 则 溶液的 |
一定条件下磷与干燥氯气反应,若0.25磷消耗掉314氯气(标准状况),则产物中与的物质的量之比接近于
| A. | 1:2 | B. | 2:3 | C. | 3:1 | D. | 5:3 |
在溶液中,反映分别在三种不同实验条件下进行,它们的起始浓度均为、及。反映物的浓度随时间的变化如下图所示。
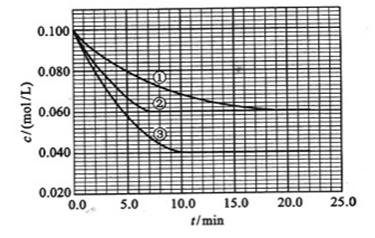

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②;
③;
(2)实验②平衡时的转化率为;实验③平衡时的浓度为;
(3)该反应的>0,判断其理由是;
(4)该反应进行到4.0时的平均反应速度率:
实验②:=;
实验③:=。
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀的化学式为。
(2)第③步反应的离子方程式是。
(3)第④步反应后,过滤所需的玻璃仪器有。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:、。
(4)若废旧锂离子电池正极材料含的质量为18.1g,第③步反应中加入20.03.0的溶液,假定正极材料中的锂经反应③和④完全转化为,则至少有参加了反应。
设为阿伏加德罗常数的值,下列叙述正确的是
| A. |
常温下,10.1的溶液中氮原子数为0.2 |
| B. |
1羟基中电子数为10 |
| C. |
在反应中,每生成3转移的电子数为6 |
| D. |
常温常压下 |
正极材料为的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型是一种潜在的锂离子电池正极材料,它可以通过、与溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将和溶液直接混合的原因是。
②共沉淀反应的化学方程式为。
③高温成型前,常向中加入少量活性炭黑,其作用除了可以改善成型后的的导电性能外,还能。
(2)废旧锂离子电池的正极材料试样(主要含有及少量等)可通过下列实验方法回收钴、锂。
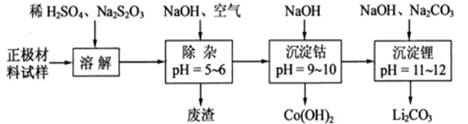
① 在上述溶解过程中,被氧化成,在溶解过程中反应的化学方程式为。
②在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为(填化学式);在350~400℃范围内,剩余固体的成分为。(填化学式)。
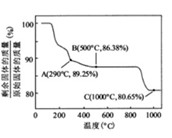
以水氯镁石(主要成分为)为原料生产碱式碳酸镁的主要流程如下

(l)预氨化过程中有沉淀生成,已知常温下的,若溶液中,则溶液中=。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为。
(3)高温煅烧碱式碳酸镁得到。取碱式碳酸镁4.66,高温煅烧至恒重,得到固体2.00和标准状况下0.896,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有,则产品中镁的质量分数(填 "升高"、"降低"或"不变")。
(多选)甲、乙两烧杯中分别装有相同体积、相同的氨水和溶液,各加入10 0.1 溶液,两烧杯中都有沉淀生成。下列判断正确的是
| A. | 甲中沉淀一定比乙中的多 | B. |
甲
 中沉淀可能比乙中的多 中沉淀可能比乙中的多
|
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中和乙中的沉淀可能一样多 |
由5 、4和3组成的混合物,加入纯铁1并在高温下和反应。若纯铁完全反应,则反应后混合物中与的物质的量之比可能是
| A. |
A 4:3 |
B. |
3:2 |
C. |
3:1 |
D. |
2:l |
接触法制硫酸工艺中,其主反应在并有催化剂存在下进行:
1)该反应所用的催化剂是(填写化合物名称),该反应时的平衡常数时的平衡常数(填"大于"、"小于"或"等于").
2)该热化学反应方程式的意义是.
3)达到化学平衡状态的是
a. b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入和,半分钟后达到平衡,测得容器中含,则:若继续通入和,则平衡移动(填"向正反应方向"、"向逆反应方向" 或"不"),再次达到平衡后,mol<<mol。
是食品工业中常用的漂白剂、抗氧化剂和防腐剂。在30时的溶解度为35.5/100。
1)计算30时饱和溶液中的质量分数。(保留2位小数)
2)计算30时271 饱和溶液中水的质量。
3)将30的饱和溶液271冷却到10,析出晶体79.5。计算10时在水中的溶解度。
白磷()是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以为例)如右图所示。该结构中氯原子有两种不同位置。

1)6.20白磷在足量氧气中完全燃烧生成氧化物, 反应所消耗的氧气在标准状况下的体积为。
反应所消耗的氧气在标准状况下的体积为。
上述燃烧产物溶于水配成50.0磷酸()溶液,该磷酸溶液的物质的量浓度为。
2)含0.300的水溶液滴加到含0.500的悬浮液中,反应恰好完全,生成l种难溶盐和16.2。该难溶盐的化学式可表示为。
3)白磷和氯、溴反应,生成混合卤化磷(,且为整数)。
如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为。
4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10和0.10恰好完全反应,生成氯化氢和0.030磷腈化合物。推算磷腈化合物的相对分子质量(提示:>300)。
化合物在一定波长的光照射下发生分解反应,反应物浓度

随反应时间变化如右图所示,计算反应4~8间的平均反应速率和推测反应16时反应物的浓度,结果应是
| A. |
2.5和2.0 |
| B. |
2.5和2.5 |
| C. |
3.0和3.0 |
| D. |
5.0和3.0 |
硼酸在食品、医药领域应用广泛。
(1)请完成气体与水反应的化学方程式:+ = +。
(2)在其他条件相同时,反应+ +中,3的转化率在不同温度下随反应时间的变化见图12,由此图可得出:
+中,3的转化率在不同温度下随反应时间的变化见图12,由此图可得出:

①温度对应该反应的反应速率和平衡移动的影响是_
②该反应的0(填"<"、"="或">").
(3)溶液中存在如下反应:
()+() -( )++()已知0.70 -1 溶液中,上述反应于298达到平衡时,(+)="2." 0 × 10-5-1,()≈(),水的电离可忽略不计,求此温度下该反应的平衡常数()的平衡浓度不列入的表达式中,计算结果保留两位有效数字)
-( )++()已知0.70 -1 溶液中,上述反应于298达到平衡时,(+)="2." 0 × 10-5-1,()≈(),水的电离可忽略不计,求此温度下该反应的平衡常数()的平衡浓度不列入的表达式中,计算结果保留两位有效数字)
硫--碘循环分解水制氢主要涉及以下反应
I
Ⅱ
Ⅲ
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中氧化性比强
c.循环过程中需补充 d.循环过程中产生1的同时产生1
(2)一定温度下,向1密闭容器中加入1 ,发生反应Ⅱ,物质的量随时间的变化如图所示。

0-2已见分晓的平均反应速率=,该温度下,的平衡常数=。
相同温度下,若开始加入的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.的平衡浓度 c.达到平衡的时间 d.平衡时的体积分数
(3)实验室用和稀硫酸制,反应时候溶液中水的电离平衡移动(填"向左"或"向右"或"不");若加入少量下列试剂中的,产生的速率将增大。
A. B. C. D.
(4)以为燃料可制作氢氧燃料电池。已知
某氢氧燃料电池释放228.8电能时,生成1液态水,该电池的能量转化率为。
常温下,将0.1氢氧化钠溶液与0.06硫酸溶液等体积混合,该混合溶液的等于
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 12.4 |
把含有和的混合溶液分成两等份,一份加入含的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
| A. | B. | ||
| C. | D. |
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式=,0(填">"、"<"或"=");
(2)在一个容积为10的密闭容器中,1000℃时加入、、、各1.0 ,反应经过l0后达到平衡。求该时间范围内反应的平均反应速率=、的平衡转化率=:
(3)欲提高(2)中的平衡转化率,可采取的措施是。
A.减少的量
B.增加的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
标准状况下氨气溶解在1水中(水的密度近似为1),所得溶液的密度为,质量分数为,物质浓度为,则下列关系中不正确的是
| A. | B. | ||
| C. | D. |
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为、、,的最高化合价为+4)作原料,生产白色颜料二氧化钛的 主要步骤如下:
主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:、。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、、、(填化学式),减少废物排放。
(4)可用于生产红色颜料(),其方法是:将556(摩尔质量为278 )溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐 色胶体中加入3336和112铁粉,鼓入足量空气搅拌,反应完成后,有大量附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料。
色胶体中加入3336和112铁粉,鼓入足量空气搅拌,反应完成后,有大量附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料。
已知 蒸发1需要吸收的能量为30,其它相关数据如下表:

则表中为
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
把500 有和的混合溶液分成5等份,取一份加入含硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A. | B. | ||
| C. | D. |
物质有下图所示转化关系(部分反应物、生成物没有列出)。其中为某金属矿的主要成分,经过一系列反应可得到和。单质可与的浓溶液发生反应,为砖红色沉淀。
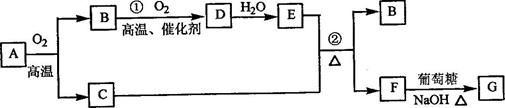
请回答下列问题:
(1)写出下列物质的化学式:
(2)利用电解可提纯物质,在该电解反应中阳极物质是
(3)反应②的化学方程式是
(4)将0.23和0.11氧气放入容积为1的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 ,则反应的平衡常数
 ,22.4乙烯中键数为4
,22.4乙烯中键数为4 粤公网安备 44130202000953号
粤公网安备 44130202000953号