2010年高考化学试题分项专题十一 金属元素及其化合物
下列叙述正确的是
| A. | 在氧气中燃烧主要生成 |
| B. | 将 通入 溶液可生成 沉淀 |
| C. | 将 通入次氯酸钙溶液可生成次氯酸 |
| D. | 将 通入热的 溶液中能使 还原成 |
能正确表示下列反应的离子方程式是
| A. | 将铜屑加入 溶液中: |
| B. | 将磁性氧化铁溶于盐酸: |
| C. | 将氯化亚铁溶液和稀硝酸混合: ↑ |
| D. | 将铁粉加入稀硫酸中: ↑ |
有、、、、和六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯为无色油状液体;、、和是盐溶液,且他们的阴离子均不同。现进行如下实验:
①有刺激性气味,用沾有浓盐酸的玻璃棒接近时产生白色烟雾;
②将分别加入其它五中溶液中,只有、中有沉淀产生;继续加入过量时,中沉淀无变化,中沉淀完全溶解;
③将分别加入、、、中,、、中产生沉淀,中有无色、无味气体逸出;
④将分别加入、、中,均有沉淀生成,再加入稀,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
下图是三种稀酸对 合金随 含量变化的腐蚀性实验结果,下列有关说法正确的是()
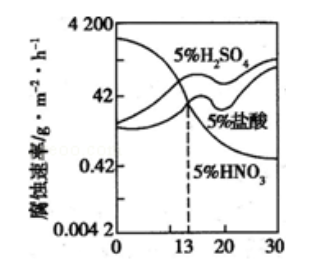
| A. | 稀硝酸对 合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B. | 稀硝酸和铁反应的化学方程式是: |
| C. | 含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对 合金的腐蚀性最强 |
| D. | 随着 含量增加,稀硝酸对 合金的腐蚀性减弱 |
将0.01下列物质分别加入100蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
① ② ③ ④
| A. | ①>②>③>④ | B. | ①>②>④>③ |
| C. | ①=②>③>④ | D. | ①=②>③=④ |
某研究性学习小组在网上收集到如下信息:溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是。
a. 边振荡盛有2%的溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的增大
【提出假设】
假设1:具有氧化性,能氧化。
假设2:溶液显酸性,在此酸性条件下能氧化。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出,验证了假设1的成立。请写出氧化的离子方程式:。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:溶液中的和都氧化了。你是否同意丙同学的结论,并简述理由:。
将0.4和1.069混合并配成溶液,向溶液中滴加0.1稀盐酸。下列图像能正确表示加入盐酸的体积和生成的物质的量的关系的是
| A. |
|
B. |
|
C. |
|
D. |
|
(多选)甲、乙两烧杯中分别装有相同体积、相同的氨水和溶液,各加入10 0.1 溶液,两烧杯中都有沉淀生成。下列判断正确的是
| A. | 甲中沉淀一定比乙中的多 | B. |
甲
 中沉淀可能比乙中的多 中沉淀可能比乙中的多
|
| C. | 甲中沉淀一定比乙中的少 | D. | 甲中和乙中的沉淀可能一样多 |
由5 、4和3组成的混合物,加入纯铁1并在高温下和反应。若纯铁完全反应,则反应后混合物中与的物质的量之比可能是
| A. |
A 4:3 |
B. |
3:2 |
C. |
3:1 |
D. |
2:l |
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0放入15.0.浓硫酸中,加热,充分应后得到溶液并收集到气体。
①甲同学认为中除外还可能含有。若要确认其中的,应先用选填序号)。
a.溶液和氯水 b.铁粉和溶液 c.浓氨水 d.酸性溶液
②乙同学取336(标准状况)气体Y通入足量溴水中,发生反应:
然后加入足量溶液,经适当操作后得干燥固体2.33。由于此推知气体中的体积分数为。
[探究二]
分析上述实验中体积分数的结果,丙同学认为气体Y中还可能含量有和气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置中试剂的作用是
(4)认为气体中还含有的理由是(用化学方程式表示)。
(5)为确认的存在,需在装置中添加于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体中含有,预计实验现象应是
(7)若要测定限定体积气体中的含量(标准状况下约有28 ),除可用测量体积的方法外,可否选用质量称量的方法?做出判断并说明理由。
碳酸锂广泛应用于陶瓷和医药等领域。已-锂辉石(主要成分为)为原材料制 备的工艺流程如下:
备的工艺流程如下:

已知:、、和以氢氧化物形式完全沉淀时,溶液的分别为3.2、5.2、9.7和12.4;、和在303下的溶解度分别为34.2、12.7和1.3。
(1)步骤Ⅰ前,锂辉石要粉碎成细颗粒的目的是.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有,另含有等杂质,需在搅拌下加入(填"石灰石"、"氯化钙"或"稀硫酸")以调节溶液的到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的溶液、石灰乳和溶液依次加入浸出液中,可除去的杂技金属离子有。
(4)步骤Ⅲ中,生成沉淀的离子方程式为。
(5)从母液中可回收的主要物质是。
各物质间的关系如下图,其中、为气态单质。

请回答下列问题:
(1)物质和的名称分别为、;
(2)可选用不同的进行反应①,若能在常温下进行,其化学方程式为;
若只能在加热情况下进行,则反应物应为;
(3)反应②的化学方程式为;
(4)新配制的溶液应加入以防止其转化为。检验溶液中阳离子的常用试剂是,实验现象为。
是自然界存在最广泛的族元素,常以化合物存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)与水反应的化学方程式为,与水反应的化学方程式为;
(2)的化学式为,和的电子式分别为;
(3)与反应可能生成的盐有(填化学式);
(4)实际生产中,可由为原料制备单质,简述一种制备方法。
下列叙述正确的是
| A. | 铝制容器可盛装热的 |
| B. | 胶体在电场中自由运动 |
| C. | 与水反应比 与水反应剧烈 |
| D. | 红磷在过量 中燃烧生成 |
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属和,并含有3.5%(质量分数)。
(1)元素在周期表中位置是
(2)与最活跃的非金属元素形成化合物,的电子式为
(3)配平用钙线氧脱鳞的化学方程式:

(4)将钙线试样溶于稀盐酸,加入过量溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,则检测的方法是
(5)取1.6钙线试样,与水充分反映,生成224(标准状况),在向溶液中通入适量的,最多能得到
物质有下图所示转化关系(部分反应物、生成物没有列出)。其中为某金属矿的主要成分,经过一系列反应可得到和。单质可与的浓溶液发生反应,为砖红色沉淀。
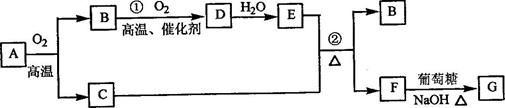
请回答下列问题:
(1)写出下列物质的化学式:
(2)利用电解可提纯物质,在该电解反应中阳极物质是
(3)反应②的化学方程式是
(4)将0.23和0.11氧气放入容积为1的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 ,则反应的平衡常数





 粤公网安备 44130202000953号
粤公网安备 44130202000953号