K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态核外电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1mol(CN)2分子中含有 键的数目为 。
键的数目为 。
(3)O 与CN
与CN 互为等电子体,则O
互为等电子体,则O 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
对由X、Y元素形成的化合物X2Y2的叙述正确的是
| A.若是离子化合物,则阳阴离子个数比肯定不等于1:1 |
| B.若由分子构成且有Y-Y键,则肯定是非极性分子 |
| C.若溶于水时有X-Y键的断裂,则肯定是强电解质 |
| D.若X、Y原子间的共价键键能大,则熔、沸点肯定高 |
若不断地升高温度,实现"雪花→水→水蒸气→氧气和氢气"的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是
| A.氢键;分子间作用力;非极性键 | B.氢键;氢键;极性键 |
| C.氢键;极性键;分子间作用力 | D.分子间作用力;氢键;非极性键 |
(共14分)已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题(用所对应的元素符号表示)。
(1)R在基态时价层电子排布式为。
(2)写出R单质与A2G2及M最高价氧化物对应水合物反应的离子方程式。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NGX、G3、等二次污染物。测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=__(填数字)。
(4)1 mol晶体L中含有σ键的数目为________。
(5)G与M可形成MG3与MG2,MG3分子的空间构型是___,
MG2中M原子的杂化方式___。
(6)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有________(填字母)。
a.离子键b.氢键c.配位键d.金属键
(8分,每空1分)(1)R、M两种元素所在周期的元素种类分别为n和m。若R的原子序数为x,当R、M均为 族元素,且M在R的下一周期时,M的原子序数为_______;当R、M均为
族元素,且M在R的下一周期时,M的原子序数为_______;当R、M均为 族元素且M在R的下一周期时,M的原子序数为_______。(用x、m、n的代数式表示)
族元素且M在R的下一周期时,M的原子序数为_______。(用x、m、n的代数式表示)
(2)在ds区中,族序数最大.原子序数最小的元素,其原子的价电子排布式为;第四周期中,未成对电子数最多的原子是(填元素符号),其未成对电子数是个。
(3)CH3+、-CH3都是很重要的有机反应中间体,它们的电子式分别是、;其中CH3+的键角应是。
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为:
按要求填空。(每空1分,共12分)
(1)E的一种核素的质量数为63,中子数为34.E的基态原子的核外电子排布式是_______基态E2+的核外电子排布式为___________E的某种化合物的结构如图所示。
微粒间的相互作用包括化学键和分子间作用力,此化合物中各种粒子间的相互作用力有_______
(2)Se的基态原子价电子轨道表示式是_____;Mn2+离子的电子排布式_____;CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C.Si.H的电负性由大到小的顺序为_______。
(3)请写出与N元素的单质互为等电子体的分子.离子的化学式、_____(各写一种)氧元素与多种元素具有亲和力,所以形成化合物的种类很多①氧元素与氟元素能形成OF2分子,该分子的空间构型为___________②根据等电子原理,在NO2+离子中氮原子轨道杂化类型是_______;1molO22+中含有的p键数目为___________
(5)科学家把NaNO3和Na2O在一定条件下反应,得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各种原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是___________
《物质结构与性质》
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为。
(2)H、N、O的电负性从小到大的顺序是。
(3)与NO2+互为等电子体的一种分子为(填化学式)。氨基(-NH2)中氮原子的杂化类型为。
(4)1mol苯分子中含有σ键的数目为。
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为。
下列说法中不正确的是()
| A.共价化合物中不可能含有离子键 |
| B.有共价键的化合物,不一定是共价化合物 |
| C.离子化合物中可能存在共价键 |
| D.原子以极性键结合的分子,肯定是极性分子 |
(16分)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。



水热冰
采用“弱电场”的条件使水结成“热冰”,说明水分子是________分子(填“极性”或“非极性”)。请你展开想象,给“热冰”设计一个应用实例____________。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
① 释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是___________________。
② 由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式___________;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式_______。
(3)写出元素组成与水相同的物质W的电子式, 写出W与FeCl2在酸性溶液中反应的离子方程式。
(4)水溶液中存在H3O+离子,写出该微粒的结构式(标出配位键)。
下列说法正确的是()
| A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D.相同物质的量的OH-和CH3+含有相同数目的电子 |
X、Y为短周期元素,X、Y可形成化合物X2Y,下列说法不正确的是
| A.X可能位于ⅠA族 |
| B.两元素形成的化合物中,原子个数比不可能是1∶1 |
| C.X与Y的简单离子可能具有相同的电子层结构 |
| D.常温常压下,X2Y可能是气体、液体或固体 |
一种新催化剂,能在室温下催化空气氧化甲醛:HCHO+O2 CO2+H2O,该反应
CO2+H2O,该反应
| A.反应物和生成物中都含极性分子和非极性分子 |
| B.生成1.8gH2O消耗2.24L O2 |
| C.反应时有极性键和非极性键的断裂和它们的生成 |
| D.为吸热反应 |
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是
A.n=2 B.A是第ⅡA族元素
C.A为-2价,B为+2价 D.该离子没有还原性
硼及其化合物在催化剂制造、储氢材料、燃料电池等方面应用广泛。Li3BN2是一种价格低廉且性能优良的储氢材料,其储氢与放氢原理为Li3BN2+4H2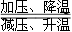 Li3BN2H8。下列有关说法正确的是
Li3BN2H8。下列有关说法正确的是
| A.B的原子半径小于N的原子半径 |
| B.H2的结构式为H—H |
| C.放氢过程为化合反应 |
| D.储氢过程没有能量变化 |