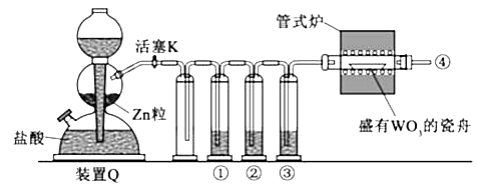
实验室用 还原 制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
| A. |
①、②、③中依次盛装 溶液、浓 、焦性没食子酸溶液 |
| B. |
管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 |
| C. |
结束反应时,先关闭活塞K,再停止加热 |
| D. |
装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是( )

A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

|
操作步骤 |
实验现象 |
解释原因 |
|
打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
|
将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
|
打开 |
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
在实验室采用如图装置制备气体,合理的是( )
|
化学试剂 |
制备气体 |
|
|
A. |
|
|
|
B. |
|
|
|
C. |
|
|
|
D. |
|
|

| A. |
A |
B. |
B |
C. |
C |
D. |
D |
实验室制备下列气体的方法可行的是( )
|
气体 |
方法 |
|
|
A |
氨气 |
加热氯化铵固体 |
|
B |
二氧化氮 |
将铝片加到冷浓硝酸中 |
|
C |
硫化氢 |
向硫化钠固体滴加浓硫酸 |
|
D |
氧气 |
加热氯酸钾和二氧化锰的混合物 |
利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
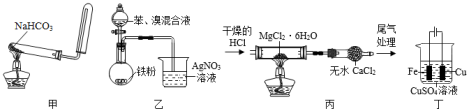
A.用甲装置制备并收集CO2
B.用乙装置制备溴苯并验证有HBr产生
C.用丙装置制备无水MgCl2
D.用丁装置在铁上镀铜
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备
KClO 3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放MnO 2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 。c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是 ,可选用试剂 (填标号)。
A.Na 2S B.NaCl C.Ca(OH) 2D.H 2SO 4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
(5)取少量KClO 3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl 4振荡,静置后CCl 4层显 色。可知该条件下KClO 3的氧化能力 NaClO(填"大于"或"小于")。
实验室以CaCO3为原料,制备CO2并获得CaCl2•6H2O晶体。下列图示装置和原理不能达到实验目的的是( )
A. 制备CO2B.
制备CO2B.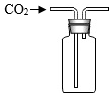 收集CO2
收集CO2
C.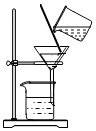 滤去CaCO3D.
滤去CaCO3D. 制得CaCl2•6H2O
制得CaCl2•6H2O
某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
【查阅资料】经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。
【设计方案】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④……;⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)Fe元素的原子结构示意图为______________。FeCl3是___________化合物(填“离子”或“共价”)。
(2)装置A中反应的化学方程式为______________。
(3)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是____________。
(4)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(5)装置B中冷水浴的作用为____________;装置C的名称为____________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂K3[Fe(CN)6]是配位化合物,其配位数为___________,配体为__________。
(6)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;FeCl3与H2S反应的离子方程式为________________。
某化学兴趣小组在加热条件下利用二氧化锰和浓盐酸反应来制取并收集氯气。
(1)若要制取纯净干燥的氯气,应使气体依次通过装有____________和__________的洗气瓶。
(2)某同学不慎将MnO2和KCl粉末混合了,分离该混合物的方法和步骤如下,请补充完整,①先在盛有混合粉末的烧杯中加入适量的水溶解;②将①所得的混合物过滤,该操作所用玻璃仪器有_________、玻璃棒、烧杯;③洗涤、干燥沉淀得到MnO2;将第②步操作所得液体_______________(填操作名称)得到KCl固体。
NH3和HNO3是重要的工业产品,下图是合成氨和氨氧化制硝酸的工艺流程。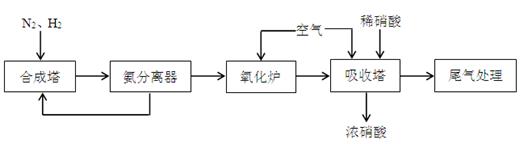
(1)合成塔中发生反应的化学方程式是 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨 的性质,从氨分离器中又回到合成塔中的物质是 。
(3)氧化炉中反生反应的化学方程式是 。
(4)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和NH3反应的化学方程式 。当有5.6LNO2被还原时,转移电子的物质的量为 mol。
(5)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是 。若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等。当进入氧化炉中气体为10m3时,最少需要空气的体积为 m3。
完成下列实验所选择的装置或仪器不正确的是
| A |
B |
C |
D |
|
| 实验 |
分离水和酒精 |
用铵盐和碱制取NH3 |
用排空气法收集NO2 |
用自来水制取蒸馏水 |
| 装置 或 仪器 |
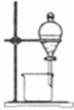 |
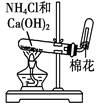 |
 |
 |
软锰矿的主要成分为MnO2,除含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: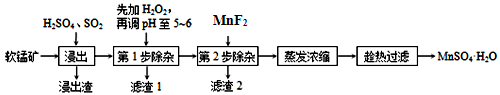
已知:①部分金属阳离子完全沉淀时的pH如下表: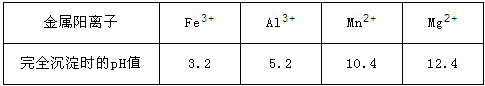
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____________。
(2)调pH至5~6的目的是___________,调pH至5~6所加的试剂可选择_________(填以下试剂的序号字母);
a.NaOHb.MgOc.CaOd.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式_________,该反应的平衡常数数值为_________。
(已知:MnF2的KSP=5.3×10-3;CaF2的KSP=1.5×10-10;MgF2的KSP=7.4×10-11)
(4)取少量MnSO4•H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是______(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为________。