在实验室采用如图装置制备气体,合理的是( )
|
化学试剂 |
制备气体 |
|
|
A. |
|
|
|
B. |
|
|
|
C. |
|
|
|
D. |
|
|

| A. |
A |
B. |
B |
C. |
C |
D. |
D |
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
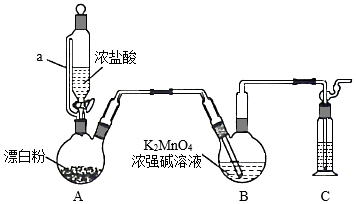
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备
KClO 3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)盛放MnO 2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 。c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是 ,可选用试剂 (填标号)。
A.Na 2S B.NaCl C.Ca(OH) 2D.H 2SO 4
(4)反应结束后,取出b中试管,经冷却结晶, , ,干燥,得到KClO 3晶体。
(5)取少量KClO 3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl 4振荡,静置后CCl 4层显 色。可知该条件下KClO 3的氧化能力 NaClO(填"大于"或"小于")。
下列气体去除杂质的方法中,不能实现目的的是( )
|
气体(杂质) |
方法 |
|
|
A. |
SO2(H2S) |
通过酸性高锰酸钾溶液 |
|
B. |
Cl2(HCl) |
通过饱和的食盐水 |
|
C. |
N2(O2) |
通过灼热的铜丝网 |
|
D. |
NO(NO2) |
通过氢氧化钠溶液 |
A.AB.BC.CD.D