环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 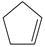 (g) =
(g) = 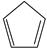 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 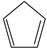 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 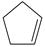 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
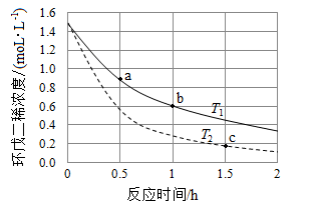
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
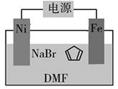

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。
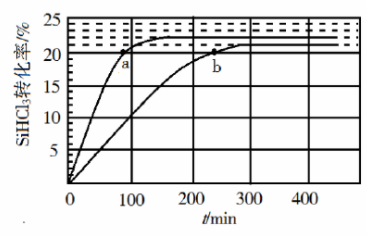
① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。