[化学--选修3:物质结构与性质]
我国科学家最近成功合成了世界上首个五氮阴离子盐 (用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
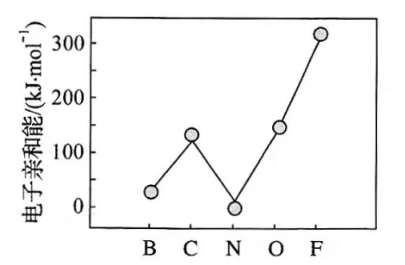
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( E 1)。第二周期部分元素的 E 1变化趋势如下图所示,其中除氮元素外,其他元素的 E 1自左而右依次增大的原因是___________;氮元素的 E 1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。
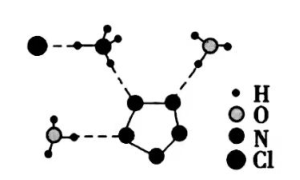
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型B.中心原子的价层电子对数
C.立体结构D.共价键类型
②R中阴离子 中的σ键总数为________个。分子中的大π键可用符号 表示,其中 m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则 中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为( )N−H…Cl、____________、____________。
(4)R的晶体密度为 ,其立方晶胞参数为 anm,晶胞中含有 y个[ ]单元,该单元的相对质量为 M,则 y的计算表达式为______________。
[化学--选修3:物质结构与性质]
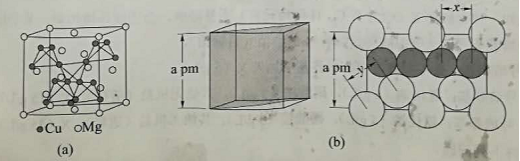
在普通铝中加入少量 和 后,形成一种称为拉维斯相的 微小晶粒,其分散在 中可使得铝材的硬度增加、延展性减小,形成所谓"坚铝",是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。
A. B. C. D.
(2)乙二胺 是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填" "或" ")。
(3)一些氧化物的熔点如下表所示:
|
氧化物 |
|
|
|
|
|
熔点/°C |
|
|
|
|
解释表中氧化物之间熔点差异的原因 。
(4)图(a)是 的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 。图(b)是沿立方格子对角面取得的截图。可见, 原子之间最短距离 , 原子之间最短距离 。设阿伏加德罗常数的值为 ,则 的密度是 (列出计算表达式)。