【2015年四川省宜宾市】黄铜是以Zn主要元素,添加元素铜的合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、 CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):

已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
(1)步骤Ⅰ中产生气体的化学方程式为 。
(2)溶液A中的金属阳离子有 (填化学式)
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
【2015年重庆A】氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:

(1)A中发生反应的化学方程式为___________。分离B中难溶物的操作I叫_________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列______(填序号)进行试验。
①稀盐酸 ②酚酞溶液 ③二氧化碳 ④氯化钠溶液
(3)操作II是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是___________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是___________。
【2015年浙江省杭州市】在实验室小金分别用甲盐的晶体配置了溶质质量分数为5%的A溶液和30%的B溶液,但忘了贴标签,请你运用两种不同的科学原理,分别设计两个简单实验来判别这两瓶溶液。请写出简要的实验方案和明确的判别依据。有下列仪器、物品供选择:量筒、天平、
小烧杯、酒精灯、三脚架、石棉网、漏斗、玻璃棒、滤纸、温度计、新鲜罗卜、甲盐的晶体。
(实验室的室温为30℃,30℃甲盐的溶解度为50g)
方案1: 判别依据:
方案2: 判别依据:
【2015年广东省】下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| NH4Cl溶解度 |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
| NaCl溶解度 |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是 。
(2)20℃时,100g水最多只能溶解NaCl g,氯化钠与氯化铵溶解度相等的温度在 ℃之间。
(3)向烧杯中加100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体为 g。
【2015贵州省安顺市】
(1)用化学用语表示:
①2个氢原子 ; ② 4个铵根离子 ; ③氧化镁中镁元素的化合价为+2价 ;
(2)甲、乙、丙三种物质的溶解度曲线如图所示,请回答:
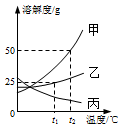
①0℃时,三种物质溶解度的大小关系是 。
②t2℃时,将50 g固体甲加入到50 g水中,充分搅拌后所得溶液的质量为 。
③若甲中含有少量乙,应用 法提纯。
【2015年湖北省武汉市】NaOH、Na2CO3、NaCl在不同溶剂中的溶解度如下表所示。
表1 NaOH、Na2CO3、NaCl分别在水中的溶解度(S/g)
| t/℃ |
NaOH |
Na2CO3 |
NaCl |
| 0 |
42 |
7.1 |
35.7 |
| 10 |
51 |
12.2 |
35.8 |
| 20 |
109 |
21.8 |
36.0 |
| 30 |
119 |
39.7 |
36.3 |
表2 常温下,NaOH、Na2CO3、NaCl分别在乙醇中的溶解度(S/g)
| NaOH |
Na2CO3 |
NaCl |
| 17.3 |
<0.01 |
0.1 |
根据表1和表2提供的数据回答下列问题:
(1)NaOH在水中的溶解度随温度升高而 (填“增大”或“减小”)
(2)20℃时,饱和食盐水中溶质的质量分数为 (计算结果精确到0.1﹪);
(3)为证明CO2能与NaOH发生反应,小明同学将CO2通入饱和NaOH的乙醇溶液中。请推测该实验可观察到的现象 ,推测依据是 。
【2015年湖北省襄阳市】右图是A、B、C三种物质的溶解度曲线,据图回答:
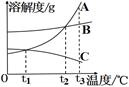
(1) ℃时, A和B两种物质的溶解度相同;
(2)t3℃时,将A、B、C三种物质的饱和溶液各100g,分别蒸发5g水,析出 晶 体最多的是 。
【2015年湖北省宜昌市】A、B、C三种固体物质的溶解度曲线如下图所示。据图回答问题:
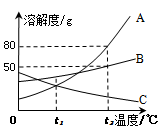
(1)温度为 ℃时,A与C物质的溶解度相等;
(2)将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,有晶体析出的是 (填字母代号);
(3)t2℃时,把A、B物质各50g分别加到100g水中,不能形成饱和溶液的是 (填字母代号),若要使之达到饱和状态,还需要向溶液中加入 g该溶质。
【2015年湖南省益阳市】下表为两种物质在不同温度时的溶解度
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
KCl |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
56.7 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
请回答:
(1)60 ℃时,KCl的溶解度是 g;
(2)40 ℃时,将30 g KCl加入到50 g水中,充分溶解后所得溶液是 溶液(填写“饱和”或“不饱和”);
(3)将20 ℃时KNO3和KCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:KNO3 KCl(填写“>”、“<”或“=”)。
【2015年山东省临沂市】已知氯化钠、碳酸钠在不同温度时的溶解度如下:
| 温度/ ℃ |
0 |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
氯化钠 |
35 |
35.5 |
36 |
36.5 |
37 |
| 碳酸钠 |
6 |
10 |
18 |
36.5 |
50 |
(1)依据上表,绘制了氯化钠和碳酸钠的溶解度曲线(如图),图中能表示碳酸钠溶解度曲线的是___________(填“A”或“B”);

(2)图中两溶解度曲线相交于M点,此点表示的意义是________________________________;
(3)40℃时,把50gA物质放入100g水中,充分搅拌,所得溶液是__________溶液(填“饱和”或“不饱和”);
(4)生活在盐湖(湖水中有溶解较多的氯化钠和碳酸钠)附近的人们习惯“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”。请你答出“冬天捞碱”的道理_________________________________________。
【2015贵州省安顺市】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,它们之间的相互转化关系如下图所示:

(1)物质A的化学式是 ;写出反应④的基本反应类型 。
(2)写出反应②的化学方程式: 。
(3)写出反应③中生成红色固体E的化学方程式: 。
【2015年湖北省荆门市】某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份。
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象。
步骤3:将另一份光亮的镁条置于热水中,观察到有气泡产生。
(1)将镁条用砂纸打磨至光亮的原因是 。
(2)经百度可知,活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱的碱性越强。某同学就向步骤3的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现。该反应的化学方程式:__________________________ ,反应类型是 (基本反应类型)。
(3)步骤2和3对比可知,影响镁与水的反应速率的一个因素是 。
(4)根据以上信息,若将金属钠加到硫酸铜溶液中,可能观察到的现象是 。
【2015年湖南省株洲市】右图是初中化学中六种常见物质之间的转化关系图。

已知A、D、F均为单质,其中D、F为金属单质,D的合金是使用最多的金属材料;B为氧化物,C是一种常见的酸,E(相对分子质量为160)的溶液呈蓝色。试回答下列问题:(框图中的反应条件和某些生成物已略去)
(1)请写出下列物质的化学式:B ,D 。
(2)上述反应中,不属于置换反应的是 (填序号)。
(3)请写出反应④的化学方程式: 。
(4)请写出E在生产生活中的一种用途 。
【2015年湖北省襄阳市】钢铁在生产、生活中有着广泛的用途。请回答:
(1)炼铁厂常以焦炭、赤铁矿石(主要成分是Fe2O3)、空气等为主要原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式: 。
(2)每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。请你写出一种防止铁锅生锈的方法: 。
【2015年湖南省益阳市】材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:Ni +H2SO4 === NiSO4 + H2↑。
根据此材料及金属活动性顺序,请回答:
(1)铸造硬币用到的材料是 (填“合成材料”或“金属材料”);
(2)写出Ni与CuSO4溶液发生置换反应的方程式 。