通过近一年的学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置,请根据下图回答下列问题:
(1)在实验室中用过氧化氢溶液和二氧化锰制取氧气,选择的发生装置是(填序号),写出反应的化学方程式;
(2)用C装置收集氧气时,应将该装置的端与发生装置连接。
| A. |
|
B. |
|
C. |
|
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。

⑴写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
⑵实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是(写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中, |
|
你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由。
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑
;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水
道?。
某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:① , 溶液呈碱性;② 微溶,但在稀溶液中看作可溶,其水溶液呈中性.)

(1)甲、乙两同学想用实验证明稀硫酸和稀
溶液确实能发生反应,设计了如图
所示的实验.丙、丁两同学想再现课本上将"澄清石灰水滴入
溶液"的实验现象,设计了如图
所示的实验。并各自进行操作.
【问题讨论】教师首先肯定了这四位同学的实验设计和操作,请你填空:
甲、乙同学将较多量的稀硫酸加入锥形瓶后,他们是依据溶液的颜色由色变为色的现象来判断两者确实发生反应的.丙、丁同学的实验中发生的复分解反应可用化学方程式表示为.
【意外发现1】甲同学和丙同学在洗刷仪器前,将
、
装置锥形瓶中的残留物倒入同一个洁净的废液缸,发现白色沉淀溶解,有气泡产生,废液缸中形成无色溶液.这一现象立刻引起了同学们的好奇,于是,他们又以"无色溶液中含有哪些溶质"为课题进行探究.
【提出猜想】经讨论呈现出如下猜想:
①溶质为:
、
②溶质为: 、 、
③溶质为: 、 、
请你判断:上述猜想中不合理的是(填数字代号).
【实验探究】小组同学针对认为合理的猜想,设计实验进行探究,请你将下表补充完整.
| 实验内容 |
实验现象和结论 |
| 取废液缸中少量溶液于试管中,滴入少量溶液,观察 |
a.若有气泡产生,则猜想成立(填数字代号) |
| b.若无气泡产生,则猜想成立(填数字代号) |
【意外发现2】乙同学和丁同学在洗刷仪器前,将 、 装置锥形瓶中的残留物倒入另一个洁净的废液缸,发现沉淀不溶,没有气泡,上层清液呈红色,此时,上层清液中溶质的组成情况可能有许多组,如:
① 、 ;
② 、 ;
③ 、 、 ;
④ 、;
⑤
、
、.(未列全.请用化学式将④、 ⑤补充完整)
(2)教师点拨:证明稀硫酸和
稀溶液确实能发生反应的方法还有多种.
【拓展探究】小组同学用其他装置继续进行实验.请你回答下列问题:
①若不加酚酞试液,将稀硫酸(适量)与
稀溶液混合后,再向其中加入
溶液,无蓝色沉淀生成,则(填"能"或"不能")证明两者确实发生了反应.
②若不加酚酞试液,将稀硫酸(少量)与
稀溶液?昆合后,再向其中加入
溶液至蓝色沉淀不再产生时,消耗了
溶液,此时还必须做一个对比实验才能证明两者确实发生了反应,这个对比实验是(简述操作方法及结论):.
还可以将上述
溶液换成溶液等(填一种物质的化学式),同样也可以证明稀硫酸和
稀溶液确实发生了反应.
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分
的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)

(1)甲组同学称取一定质量的赤铁矿粉,采用如图6的装置进行实验.
①装置
中发生反应的化学方程式是.
②为充分吸收反应生成的
,装置
中应盛放的试剂是浓溶液.
③可以通过下面不同的方法计算赤铁矿粉中
的含量:
【方法一】称量反应前后
装置的总质量,计算出
的含量;
【方法二】称量得出反应生成的
质量,计算出
的含量.
(2)乙组同学称取等质量的赤铁矿粉放人烧杯中,向烧杯中加入过量的稀硫酸充分反应,(填一个操作名称)后立即称量.根据称量的数据计算出
的含量.
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价.
| 方案 |
优点 |
| 甲组 |
① |
| 乙组 |
② |
学生在实验室中选用如图4所示装置制取气体,请你根据所学的知识回答下列问题。

(1)写出图中标号①的仪器名称:。
(2)若用
装置制取氧气,其试管口须略向下倾斜的原因是。
(3)写出用石灰石和稀盐酸制取二氧化碳的化学方程式:。组装一套发生与收集二氧化碳的装置,应选用上图中的和(填字母)。
请你用已经掌握的实验室有关气体制取和净化等知识回答下列问题:

⑴写出上图中
、
仪器名称:
,
。
⑵实验室用高锰酸钾制取氧气时,可选用的发生装置是(填装置代号),若用装置
收集氧气,如何确定气体已经收集满,实验结束时的正确操作顺序为:先后,写出该反应的化学方程式:。
⑶若用
装置收集
,则
应从导管口(填"
"或"
")通入。
⑷若用
装置收集某种气体,则该种气体应具备的性质是,试写出一个制取该种气体的化学方程式:。
⑸某课外小组的同学用上图B装置使草酸分解并用如下装置探究草酸分解的产物:


①该装置中,
的作用是,
的作用是,
(填"能"或"不能")互相交换。
②实验观察到
处无水硫酸铜变蓝,
和
处澄清石灰水都变浑浊,
处澄清石灰水无浑浊现象,
处黑色粉末变成红色,说明草酸分解的产物是。
以下是实验室常用部分仪器:

(1) 指出图中仪器的名称:④;
(2) 小李同学选择仪器制取并收集氧气,已知他使用了仪器①③⑤⑥,那么他还需要使用上图仪器中的(填序号);该发生装置检查气密性的方法是:把导管的一端浸在水里,用手紧贴试管外壁,若导管口有,则说明该装置不漏气。
(3)小张同学正在收集一瓶CO2, 不知是否收集满了,其验满方法是。
(4)某兴趣小组选用上述仪器,用锌粒和稀硫酸制氢气,锌粒反应完后,发现还有较多的灰黑色固体物质,从反应后的混合物中分离得到该灰黑色固体的操作方法是。
【提出问题】灰黑色固体物质的成分是什么呢?
【提出猜想】①可能含有单质碳;②可能含有单质铜;③可能还有其它物质
【设计实验】请设计实验用化学方法证明该灰黑色固体物质中是否含有单质碳和单质铜。
完成下表(不一定要填满):
| 步骤 |
实 验 方 法 |
现 象 和 结 论 |
| 1 |
||
| 2 |
||
| 3 |
【反思讨论】上述各步反应完全后,兴趣小组的同学还收集到了少量剩余黑色固体物质,为了进一步探究剩余固体物质的成分,兴趣小组的同学讨论后,认为用初中化学知识无法解决,你对下一步的探究学习活动的合理建议是:首先 。
过氧化氢(化学式
)溶液在
作催化剂的条件下能迅速分解生成
和
,分液漏斗可以通过调节活塞控制液体的滴加速度。
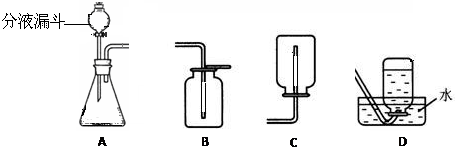
回答下列问题:
(1)分液漏斗中应放入的物质是,锥形瓶中应放入的物质是 。
(2)写出该方法制取
的化学方程式;要收集一瓶较纯净的
,应选择装置(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用B装置收集
,过一段时间后,用带火星的木条伸到瓶口,看到木条 ,表明已收集满。
(4)若实验时用此法代替
加热制取
,优点是 (填编号)。
①生成物只有氧气 ②不需加热 ③需加热
(5)装置A中反应很剧烈,据此提出实验安全注意事项是(填编号)。
①控制液体的滴加速度 ②用体积较小的锥形瓶 ③加热反应物
(6)写出用装置A制取另外2种气体的化学式 和 。
叠氮化钠(
)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发
,迅速分解为
,反应方程式为。
【制备研究】
(2)将金属钠与液态氨反应得
,再将
反应可生成
和
气体
,该反应的化学方程式为
,实验室检验
气体使用的试纸是湿润。
【
质量分数测定】
工业级
中常含有少量的
,为测定样品中
的质量分数设计如图装置(已知
溶液与
,反应不生成气体)。
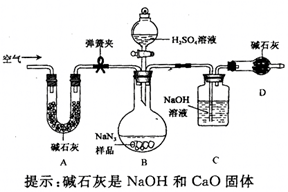
(3)装置
的作用是。设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置
;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,;⑤再次称量装置
。计算碳酸钠含量至少需要测定(填数字)个数据。根据制备反应,分析工业级
中含有
的可能原因。
| M |
【 纯度测定】
精确称量
样品,设计如图装置,测定其纯度。已知
(
中的
全部转化为
,其他产物略),反应中放出大量的热。
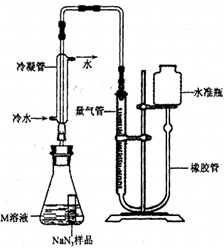
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差(填"变大"、"变小"或"不变"),说明气密性良好。
(5)使小试管中的
样品与
溶液接触的操作是。
(6)使用冷水冷凝的目的是。反应前应将液面调节到量气管的"0"刻度,并使两边液面相平,反应后读数时,还需要进行的操作是
(7)常温下测得量气管读数为67.2
的密度为1.25
),则实验中选用的量气管规格合适的是(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算
样品的纯度(写出计算过程)