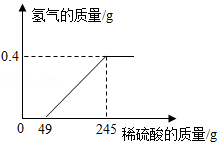
小明用镁条(表面被氧化)和稀硫酸反应的实验来测定稀硫酸的溶质质量分数。实验中,他绘制了生成氢气的质量与所用稀硫酸质量的关系图(如图),请根据如图计算该稀硫酸的溶质质量分数。
实验室测定一瓶稀硫酸中溶质的质量分数,取该稀硫酸100g,加入足量的氯化钡溶液,完全反应后生成46.6g沉淀.试计算该稀硫酸中溶质的质量分数.
现有溶质质量分数为20%的NaOH溶液20g,与一定质量的稀盐酸恰好完全反应。
计算:(1)NaOH溶液中溶质的质量为 g
(2)生成NaCl的质量。
我国在2017年"世界环境日"(6月5日)确定的主题是"绿水青山,就是金山银山".华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm 3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是 g.
(2)污水中所含NaOH的质量分数是多少?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸 克才能使碳酸钠恰好完全变成硫酸钠.
将适量二氧化碳通入100g氢氧化钠溶液中。恰好完全反应后,得到108.8g碳酸钠溶液请计算:
(1)参加反应的二氧化碳的质量为 g;
(2)氢氧化钠溶液的溶质质量分数。
某课外兴趣小组的同学取14g大理石样品(主要成分是CaCO3)于烧杯中,将50克稀盐酸分成5次加入到烧杯中充分反应(已知大理石样品中其余成分不溶于水,也不与稀盐酸反应),得到如下数据:
次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
加入稀盐酸的质量/g |
10 |
10 |
10 |
10 |
10 |
烧杯中剩余物的总质量/g |
22.8 |
31.6 |
40.4 |
49.6 |
59.6 |
试计算:
(1)实验过程中生成气体的总质量 g;
(2)实验最终所得溶液中CaCl2的质量分数(写出计算过程);
(3)第4次加入10g稀盐酸所产生气体的质量 g。
某学习小组欲测定刚配制的BaCl2溶液中溶质的质量分数,采取下列两种方法:
方法1:取100gBaCl2溶液,加入适量的AgNO3溶液,两者恰好完全反应,并测得生成AgCl沉淀的质量为m1g;
方法2:取100gBaCl2溶液,加入m2g溶质的质量分数为a%的Na2SO4溶液,恰好使BaCl2溶液完全沉淀;
已知相关物质的相对分子质量:BaCl2=208 Na2SO4=142 AgCl=143.5
(1)请任选一种方法计算该BaCl2溶液中溶质的质量分数(写出详细的计算过程);
(2)如果采取上述两种方法,可推知a= (用含m1、m2的代数式表示)
实验室现有一瓶标签破损的稀硫酸溶液,为了测定其溶质的质量分数,某同学进行了以下实验:用一个洁净的小烧杯取该溶液100克,向其中加入足量的锌粒,充分反应后,烧杯内剩余物质的质量减少了0.4克。(反应的化学方程式:Zn+H2SO4═ZnSO4+H2↑)试求:
(1)H2SO4的相对分子质量
(2)该稀硫酸溶液中溶质的质量分数(要求:结合化学方程式计算,并写出计算过程)
某化学兴趣小组为研究酸的化学性质,他们将一定量稀硫酸加入到盛有少量CuO的试管中,观察到黑色粉末全部溶解,溶液呈 色,该反应的化学方程式为 。为进一步确定反应后所得溶液中的溶质成分,他们进行了以下实验探究。
【提出猜想】猜想一: ;猜想二:H 2SO 4和CuSO 4
【资料查询】CuSO 4溶液呈弱酸性,加入Zn粒时有极少量的气体产生。
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案。
方案一:取所得溶液少许于试管中,滴入石蕊试液,振荡,若观察到溶液显红色,则猜想二正确。
方案二:取所得溶液少许于另一支试管中,加入足量Zn粒,若观察到产生大量气体、 等现象,则猜想二正确。
【讨论交流】A、经过讨论,大家一致认为方案一是错误的,其理由是 。
B、要使由H 2SO 4和CuSO 4组成的混合溶液中的溶质只有CuSO 4,可向其中加入过量的 (填序号)。
a、CuO b.Cu(OH) 2 c、Cu d.Cu(NO 3) 2
【拓展探究】某混合溶液由硫酸和硫酸铜溶液组成。上述小组同学又进行了如下实验:取124.5g该混合溶液于烧杯中,然后将120gNaOH溶液分六次加入其中,毎次充分反应后称量所得溶液的质量,所测数据如下表所示。
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
| 加入NaOH溶液的质量/g |
20 |
20 |
20 |
20 |
20 |
20 |
| 反应后溶液的质量/g |
144.5 |
164.5 |
179.6 |
189.8 |
200 |
220 |
| 每次产生沉淀的质量/g |
0 |
0 |
m |
n |
9.8 |
0 |
计算:
(1)上述表格中产生沉淀的质量:m= ,n= 。
(2)所加NaOH溶液中溶质的质量分数。
(3)第5次加入NaOH溶液充分反应后所得溶液中溶质的质量分数。
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下

请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 肥;
(2)该同学制得氧气的质量 g;
(3)计算滤液中溶质质量分数。
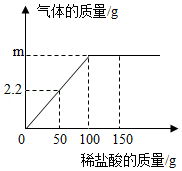
小苏打是发酵粉的主要成分之一,可用于制作发面食品。一化学兴趣小组对某小苏打样品中各成分的含量做了如下测定:将一定质量的该样品(已知杂质只含NaCl)加水全部溶解后,得到104.4g溶液,向该溶液中逐渐加入稀盐酸,产生的气体与加入稀盐酸的质量关系如图所示。试计算:
(1)m的值为 。
3与NaCl的质量比 。
某化学兴趣小组为了测定某纯碱样品(只含有Na2CO3、NaCl)中Na2CO3质量分数,取5克样品,往其中加入一定质量的稀盐酸,产生气体的质量与所加稀盐酸的质量变化如图,试计算:
(1)共产生 克二氧化碳;
(2)该纯碱样品中Na2CO3的质量分数;
(3)求恰好完全反应时所得溶液的质量分数?

某化学课外活动小组的同学在学习《化学》下册77页的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的CaCO3当遇到溶有CO2的水时,会反应生成溶解性较大的Ca(HCO3)2:【CaCO3+CO2+H2O═Ca(HCO3)2】.联想到实验室检验CO2时,将气体通入澄清石灰水中.若长时间往澄清石灰水中通入CO2会产生什么样的现象呢?小组决定用小烧杯盛装一定量的氢氧化钠溶液并不断通入二氧化碳气体进行探究
【提出问题】氢氧化钠溶液中通入二氧化碳一段时间后,溶液中含有什么溶质?
【查阅资料】
(1)通入少量的二氧化碳时,NaOH与CO2反应的化学方程式为: .
(2)通入过量CO2时,反应的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3.
(3)碳酸氢盐都是可溶于水的.BaCO3难溶于水且是白色固体.
(4)Na2CO3、NaHCO3溶液呈碱性,BaCl2显中性.
【提出猜想】
(1)溶质为NaOH和Na2CO3;
(2)溶质为Na2CO3;
(3)溶质是 (填化学式);
(4)溶质全都是NaHCO3.
【设计实验方案】
实验步骤 |
实验现象 |
实验结论 |
①用试管取少量小烧杯中反应后的溶液,滴加几滴 试液(填酸碱指示剂) |
溶液变红色 |
该溶液显碱性 |
②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 |
有 生成 |
猜想(4)不成立 |
③取步骤②中的上层清液,滴入稀盐酸 |
有气泡冒出 |
猜想(1)和(2)不成立 |
【得出结论】猜想(3)成立.
【讨论交流】
(1)有同学提出实验步骤①是多余的.你认为该实验设计是否需要?并说明理由 .
(2)将实验步骤②剩下混合物进行 (填操作名称)、洗涤、干燥、称量,发现所得沉淀质量等于步骤②中所称量的溶液质量的十分之一,判断氢氧化钠溶液中通入二氧化碳一段时间后,溶液中 Na2CO3的质量分数约为 .
A.4.26% B.5.38% C.3.43%.10%
【反思应用】
验证二氧化碳性质时,如果长时间向澄清石灰水中通入二氧化碳会看到什么样的现象呢?请你描述一下 .