铁的冶炼与利用是学习和研究化学的重要课题。
Ⅰ.铁的冶炼。竖炉炼铁的工艺流程如图1所示。
(1)“燃烧室”中CH4燃烧的作用是
(2)写出“还原反应室”中炼铁的一个反应的化学方程式 。
(3)CH4与高温尾气中的CO2或H2O都能反应生成CO和H2,则16g CH4在催化反应室中完全反应后,理论上得到H2的质量(m)范围是 。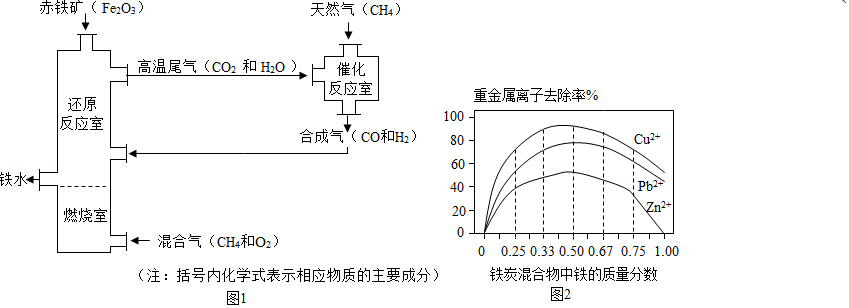
Ⅱ.铁的利用,利用铁炭混合物(铁屑和活性炭的混合物)处理含有Cu(NO3)2,Pb(NO3)2和Zn(NO3)2的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
(1)铁炭混合物中铁的质量分数为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,其原因是 。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是 。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为 。
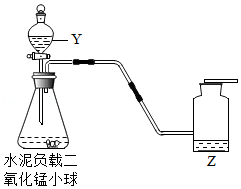
如图装置可用于多次连续进行氧气的制取和性质的实验。
(1)仪器Y的名称是 。
(2)水泥负载二氧化锰小球用于实验时的主要优点是 。该实验中收集氧气的方法是 。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是 。
②硫粉燃烧。Z为NaOH溶液,其作用是 。
③蜡烛燃烧。Z为 ,其作用是验证蜡烛中含有碳元素。
(4)实验时需要1.6g氧气,至少需要加入多少克5%的过氧化氢溶液。(写出计算过程)
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用37%的浓盐酸配制200g7.3%的盐酸,需要加水(密度为1g•mL﹣1) mL.(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100g,判断电解槽中NaOH溶液是否达到高浓度标准。(写出计算过程)
某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一种溶质),取废水样品200g,逐滴加入溶质质量分数为5%的氢氧化钠溶液,废水中硫酸的质量随加入氢氧化钠溶液质量变化如图所示,
(1)要配制100g 5%的氢氧化钠溶液,需氢氧化钠固体质量为 g;
(2)计算该废水中硫酸的质量分数(写出计算过程)。

海水中含有丰富的自然资源,一般是先将海水淡化获得淡水,再通过一系列工艺流程从剩余的浓海水中提取其他产品,从浓海水制取镁的主要反应过程如图所示。

请回答下列问题
(1)用浓海水可以制得粗盐,方法是 。
(2)电解熔融氯化镁的化学方程式为 。
(3)溶解1.16吨氢氧化镁至少需要质量分数为10%的稀盐酸多少吨?请写出计算过程。
取含杂质的硫酸镁样品7g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液(密度为1.06gcm3),恰好完全反应,得到71g溶质质量分数为10%的溶液。计算:
(1)样品中硫酸镁的质量;
(2)所加入的氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%);
(3)所加入的氢氧化钠溶液的体积(计算结果精确至0.1)。
金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的 性(填“导热”或“导电”)。
(2)图为洁净铁钉的有关实验。

①中铁与硫酸铜反应的化学方程式为 。
②中铁钉锈蚀主要是铁与空气中的氧气和 发生化学反应。
③中铁锈与稀硫酸反应的化学方程式为 。
(3)某炼铁厂要冶炼1000t含杂质3%的生铁,需要含Fe2O380%的赤铁矿石的质量是 t(计算结果精确至0.1t)。
(4)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是 (填序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12g
D.加入的稀硫酸的溶质质量分数为19.6%
现有一定质量的硝酸钠和氯化钠的混合物,其中含钠元素9.2g。将此混合物加足量水配成溶液,再加入一定量硝酸银溶液,恰好完全反应,生成氯化银白色沉淀28.7g。计算:
(1)原混合物中氯化钠的质量;
(2)原混合物中硝酸钠的质量分数(结果保留至0.1%)。
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
金属材料广泛应用于生产生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是 。
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为 。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是 (写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式 。
② 冶炼2900t含四氧化三铁80%的磁铁矿石, 理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
(5)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为 g。
碱式碳酸铜是孔雀石的主要成分,俗称铜绿,化学式为Cu2(OH)2CO3,受热可分解生成CuO、水和二氧化碳。
(1)碱式碳酸铜的相对分子质量是 。
(2)铜绿分解生成22g的二氧化碳的同时,生成CuO的质量是多少?
黄铜(铜锌合金)的外观与黄金极为相似,容易以假乱真。小红同学想测定黄铜中锌的含量。她称取20g黄铜样品放入烧杯中,加入足量稀硫酸充分反应后,测得生成氢气的质量为0.2g。
(1)该反应属于 (填基本反应类型)。
(2)求黄铜中锌的质量分数。(写计算过程)
兴趣小组的同学在社会实践基地发现一袋商标模糊的硝酸铵化肥。同学们要帮助基地的工作人员测定化肥中硝酸铵的含量,请你参与他们的探究活动。
[查阅资料]1.铵态氮肥易溶于水。2.铵态氮肥与碱反应产生氨气。3.氨气易溶于水,溶液呈碱性。
[实验过程]小丽同学准确称取9.0 g硝酸铵化肥样品,与过量的氢氧化钙粉末混合,充分反应后,产生的氨气用足量的稀硫酸全部吸收,测得2分钟内稀硫酸溶液质量的变化,记录如下表所示(样品中的杂质不含氮元素,也不与氢氧化钙反应)。
时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
溶液增加的质量/g |
0 |
0.7 |
1.2 |
1.5 |
1.6 |
1.7 |
1.7 |
[数据处理]
计算此化肥中硝酸铵的质量分数(写出计算过程)
[反思交流]
化肥对粮食增产有着重要的作用,如何科学合理使用或贮存铵态氮肥,请你给工作人员提一条合理化建议 。