有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag等金属中的一种或几种组成。取该样品2.4g,加入100g稀硫酸恰好完全反应,得0.2g H2和无色溶液。下列说法正确的是( )
A.样品中一定只含有Mg
B.样品中一定不含有Ag,可能含有Fe
C.无色溶液中溶质总质量为12g
D.稀硫酸的溶质质量分数为19.6%
下列选项中相关量的变化与图象不相符的是( )
选项 |
X |
Y |
|
A.向一定量饱和食盐水中加水 |
水的质量 |
溶质质量 |
|
B.向一定量锌粒中加稀硫酸 |
稀硫酸质量 |
氢气质量 |
|
C.向一定量CuCl2溶液中加NaOH溶液 |
NaOH溶液质量 |
沉淀质量 |
|
D.向一定量水中加KNO3晶体 |
KNO3晶体质量 |
溶质质量分数 |
A.AB.BC.CD.D
金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的 性(填“导热”或“导电”)。
(2)图为洁净铁钉的有关实验。

①中铁与硫酸铜反应的化学方程式为 。
②中铁钉锈蚀主要是铁与空气中的氧气和 发生化学反应。
③中铁锈与稀硫酸反应的化学方程式为 。
(3)某炼铁厂要冶炼1000t含杂质3%的生铁,需要含Fe2O380%的赤铁矿石的质量是 t(计算结果精确至0.1t)。
(4)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是 (填序号)。
A.样品中一定含有镁
B.样品中一定不含有银,可能含有铁
C.所得溶液中溶质总质量为12g
D.加入的稀硫酸的溶质质量分数为19.6%
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3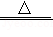 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
金属材料广泛应用于生产生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是 。
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为 。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是 (写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式 。
② 冶炼2900t含四氧化三铁80%的磁铁矿石, 理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
(5)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为 g。
向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的是( )
A.
B.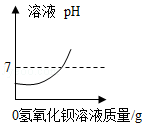
C.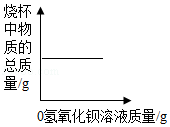
D.
下列图象能正确反映其对应的实验操作的是( )
A. 电解水生成氢气和氧气
电解水生成氢气和氧气
B.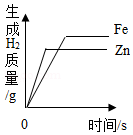 分别向等质量的铁粉和锌粉中加入过量的完全相同的稀硫酸
分别向等质量的铁粉和锌粉中加入过量的完全相同的稀硫酸
C.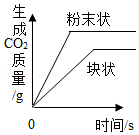 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
D.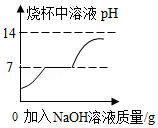 向盛有一定质量的CuSO4和稀硫酸混合溶液的烧杯中逐滴加入NaOH溶液至过量
向盛有一定质量的CuSO4和稀硫酸混合溶液的烧杯中逐滴加入NaOH溶液至过量
下列四个图象分别对应四个变化过程,其中正确的是( )
A. 一定量的饱和石灰水中加入氧化钙
一定量的饱和石灰水中加入氧化钙
B. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C. 向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
D. 向氢氧化钾溶液中不断加水,溶液的pH与加入水的质量关系
向氢氧化钾溶液中不断加水,溶液的pH与加入水的质量关系
下列图象能正确反映对应变化关系的是( )
A. 将表面生锈的铁钉放入稀盐酸中
将表面生锈的铁钉放入稀盐酸中
B. 红磷在密闭容器中燃烧
红磷在密闭容器中燃烧
C. 向硫酸铜溶液中加入锌粉
向硫酸铜溶液中加入锌粉
D. 向稀盐酸中滴加硝酸银溶液
向稀盐酸中滴加硝酸银溶液
下列图象中正确反映了其对应操作的是( )
A.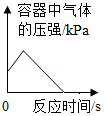 在盛有空气的密闭容器中点燃红磷
在盛有空气的密闭容器中点燃红磷
B. 向NaOH溶液中不断加入水
向NaOH溶液中不断加入水
C. 将浓硫酸敞口放置在空气中
将浓硫酸敞口放置在空气中
D. 分别向等质量的锌粉和铁粉中,加入足量且质量分数相等的稀盐酸
分别向等质量的锌粉和铁粉中,加入足量且质量分数相等的稀盐酸
将铜粉和铁粉的混合物 m g 放入烧杯中,向烧杯中不断加入FeCl3溶液,测得烧杯中剩余固体的质量与加入 FeCl3 溶液体积的关系如图所示。下列相关说法正确的是( )
[小资料]
铁和铜都能与 FeCl3溶液发生反应,反应的化学方程式为:Fe+2FeCl3=3FeCl2;Cu+2FeCl3=2FeCl2+CuCl2
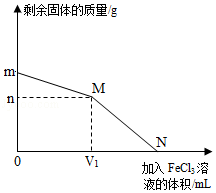
A.FeCl3 与Cu 发生的化学反应属于置换反应
B.铜粉和铁粉的混合物中,铁粉的质量为(m﹣n) g
C.N 点对应的溶液中一定含有 Fe2+、Cu2+和 Cl﹣
D.当加入V1 mL FeCl3 溶液时,Cu 恰好完全反应
下列图象不能正确反应其对应变化关系的是( )
A. 相同质量的炭粉分别在足量的氧气和空气中燃烧
相同质量的炭粉分别在足量的氧气和空气中燃烧
B.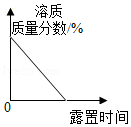 浓硫酸长期露置在空气中
浓硫酸长期露置在空气中
C. 向表面生锈的铁钉中滴加过量的稀盐酸
向表面生锈的铁钉中滴加过量的稀盐酸
D. 向一定量氯化铜溶液中滴加氢氧化钠溶液
向一定量氯化铜溶液中滴加氢氧化钠溶液
下列图象不能正确反应其对应变化关系的是( )
A.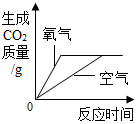 相同质量的炭粉分别在足量的氧气和空气中燃烧
相同质量的炭粉分别在足量的氧气和空气中燃烧
B.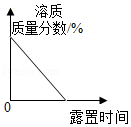 浓硫酸长期露置在空气中
浓硫酸长期露置在空气中
C.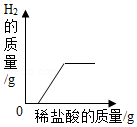 向表面生锈的铁钉中滴加过量的稀盐酸
向表面生锈的铁钉中滴加过量的稀盐酸
D.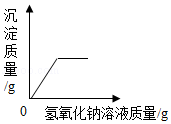 向一定量氯化铜溶液中滴加氢氧化钠溶液
向一定量氯化铜溶液中滴加氢氧化钠溶液
现有碳酸钙和单质铁的混合物,为测定其组成,取一定质量该混合物放于烧杯中,向烧杯中加入200g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到一定温度下的不饱和溶液210.9g,则所取混合物中单质铁的质量为下列各项中的( )
A.8.4gB.2.8gC.11.2gD.5.6g
化学不仅支持高新技术的快速发展,还为解决能源、资源等问题提供有效途径。
(1)2019年1月,嫦娥四号登月探测器成功登陆月球表面。构成月球探测器的部件有碳化硅(SiC)光学仪器、有机高分子反光板、钛合金筛网车轮等,其中碳化硅(SiC)属于 材料。
(2)港珠澳大桥在建造过程中使用了大量的不锈钢钢筋,主要利用了其强度高和 的性质。
(3)将生活垃圾中的可燃物分离出来对其进行处理可以得到汽油、煤油等燃料,从而实现资源的循环再利用。下列生活垃圾中能实现上述转化的有 (填序号)。
a.废铁 b.玻璃 c.易拉罐 d.废塑料
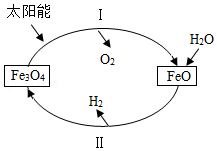
(4)太阳能的利用为人类提供充足的氢能源。工业上以太阳能为能源,利用铁的氧化物循环分解水制氢气的流程如图所示:
①过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→ →热能。
②写出过程Ⅱ反应的化学方程式 。
③当过程Ⅱ中得到ag H2时,过程I中得到的O2质量为 g。