利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁。现有80g废铁屑与430mL20%的稀硫酸(密度为1.4g/cm3)恰好完全反应(假设废铁屑中除铁以外的物质不溶于水且不与稀硫酸反应)。我能完成下列计算(结果保留整数):
⑴稀硫酸中溶质的质量;
⑵废铁屑中铁的质量;
⑶恰好完全反应时所得溶液中溶质的质量分数。
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含
有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品
放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总
质量为80.6g。试计算:
⑴产生二氧化碳气体的质量是 g。
⑵该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含量进行测定,三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:
| 组别编号 |
样品质量(克) |
加入稀硫酸质量(克) |
剩余固体质量(克) |
| 1 |
10 |
20 |
8.4 |
| 2 |
10 |
30 |
8 |
| 3 |
10 |
40 |
8 |
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
钢铁的生产和使用是人类文明和社会进步的一个重要的标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是
。
(2)校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)
| 实验序号 |
1 |
2 |
3 |
4 |
| 生铁样品的质量 / g |
2.88 |
5.76 |
9.24 |
10.28 |
| 生成H2的体积(标准状况下)/L |
1.12 |
2.24 |
3.36 |
m |
通过计算回答下列问题:
①上述表格中m的值为 。
②根据表中数据计算稀硫酸中H2SO4的质量分数。
根据右图浓盐酸的商标,回答下列问题
(1)某研究小组的同学欲用该盐酸配制100g10%的稀盐酸,需该盐酸 g(保留一位小数),配制时应选用 (填“10ml”或“50ml”)量筒量取。
(2)小组同学用所配制稀盐酸来测量水垢【主要成分为CaCO3和Mg(OH)2】中CaCO3的质量分数:取10.0g水垢,加入所配100g10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
通过实验,计算该水垢中CaCO3的质量分数。
宇航员在太空舱中,往往可利用自己呼出的二氧化碳与过氧化钠粉末作用来获得所需的氧气,并合理处理呼出的二氧化碳。(反应方程式为2Na2O2+2CO2===2Na2CO3+O2)假如某宇航员在某次太空飞行中预计消耗氧气480kg,则该宇航员应在太空舱中至少准备多少克过氧化钠。(要求写出计算过程)
氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中的单质铜的含量进行测定。三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的同浓度的稀硫酸,充分反应后,对烧杯中剩余固体进行称量。实验数据记录如下:
| 组别 |
样品质量(克) |
加入稀硫酸质量(克) |
剩余固体质量(克) |
| 1 |
10 |
20 |
8.4 |
| 2 |
10 |
30 |
8 |
| 3 |
10 |
40 |
8 |
(1)分析表中数据可知,第2组实验中剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质),某化学兴趣小组为了测量纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应.过滤干燥后,称得沉淀质量为19.7g.请计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%)
氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:
(1)写出Na2CO3与CaCl2反应的化学方程式 ▲ 。
(2)图中AB段表示的意义是 ▲ 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 ▲ g;
②KCl的质量是 ▲ g;
③钾元素的质量分数是 ▲ 。
(4)所用N a2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)
造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
(1)回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的______污染。秸秆的主要成分是纤维素[(C6H1005)n],纤维素中C、H、O三种元素的质量比为______(用最简整数比表示)。
(2)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
①检测废水呈碱性的简单方法是_____。
②若某造纸厂废水中NaOH的质量分数为l.6%,现有废硫酸9.8 t(H2SO4的质量分
数为20%),可以处理的废水质量是多少?(计算过程写在答题卡上)
如图所示,有人制作了一个家庭制氧装置。该制氧装
置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱。药剂包括过氧碳酸钠(2
Na2 C03·3 H2 O2)和二氧化锰。制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入
药剂:产生的气体通过B管从乙瓶导出,即可供人吸氧。
(1)为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应 ▲ 。(选填“不伸入液面’’或“伸人液面")
(2)药剂加入水中后会发生以下两个反应: 2 Na2 CO3·3 H2O2="2" Na2 CO3+3 H2O2;
2H2 O2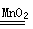 2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。
2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。
(3)已知一包总质量为110克的药剂可34克过氧化氢,则这包药剂完全反应会生成多少克氧气?
为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20g,逐滴加入氢氧化钡溶液30g,同时用PH计测定并记录反应过程中混合溶液PH 变化情况(如图所示).过滤后得滤液47.67g.请你计算,求出氢氧化钡溶液的溶质质量分数.可能用到的相对原子质量:H-1 0-16 S-32 Ba -137
2010年全国两会期间,与会人员领到的会议通知、日程表、便签纸等都是外观与普通纸相似的“石头纸”。“石头纸”的主要原料为碳酸钙,加上少量聚乙烯和胶合剂制成(聚乙烯和胶合剂不溶于水且不与盐酸反应)。
(1)“石头纸”中的碳酸钙属于 (选填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
(2)为恶劣测定某种“石头纸”中碳酸钙的质量分数,某同学取该种“石头纸”样品10克,加入100克7.3%的盐酸溶液充分反应。反应后烧杯内剩余物质的总质量为106.48克;经过滤干燥后称得固体残渣质量为2克。
该同学想出甲、乙、丙三种计算方案:
甲:根据“反应后烧杯内剩余物质的总质量106.48克,可知二氧化碳的质量,……”求解;乙:根据“反应后经过了干燥后称得固体残渣的质量2克,可知样品中碳酸钙的质量,……”求解;
丙:根据“100克7.3%的盐酸溶液,可知参加反应的氯化氢质量,……”求解。
以上方案中,不正确的是 。
(3)根据上述的某个正确方案计算该“石头纸”中碳酸钙的质量分数。
将一定量的CO2缓缓通入足量的澄清石灰水中,随时间的进行生成的沉淀质量如右图所示,回答下列问题:
(1)反应达到t时生成的沉淀质量为 g
(2)若改为碳酸氢钠与足量的澄清石灰水反应为,生成相同质量的沉淀,则需要的碳酸氢钠固体的质量为多少克?提示反应的化学方程式为: NaHCO3+Ca(OH)2==CaCO3↓+NaOH+H2O
为测定某碳酸氢铵化肥中的含氮量,小滨在实验室里取用8.5 g该化肥样品与20g NaOH溶液共热,恰好完全反应,测得残留物为26.8 g(提示:反应的化学方程式为NH4HCO3+2NaOH="=" Na2CO3+2H2O+NH3↑,生成的氨气全部逸出,其他成分不含氮,也不参加反应)。试求:
(1)生成氨气的质量。
(2)该化肥中氮元素的质量分数(计算结果精确到0.1%)。
(3)所用溶液的溶质质量分数。