欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
超市卖的纯碱产品中往往会含有少量的氯化钠,为了测定其组成,某校化学兴趣小组的同学对其进行了如下实验:
(1)用试管取适量样品,先向其中加入过量稀硝酸,再滴入适量硝酸银溶液,若观察到 ,则证明该样品中含有氯化钠。
(2)为测定该产品中碳酸钠的含量,进行如下定量实验:
①根据质量守恒定律,该实验所得无色气体的质量是 。
②计算该6g纯碱样品中碳酸钠的质量,请写出计算过程。(计算结果精确至O.lg)
某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为 g(用代数式表示).
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
将一定质量的碳酸钠粉末溶于200g水中配制成溶液,取1/4该溶液,向其中加入20%的氯化钙溶液至不再产生沉淀(反应方程式为CaCl2 + Na2CO3 ="==" CaCO3↓+ 2NaCl),所得沉淀的质量与加入氯化钙溶液的质量关系如图所示,试计算碳酸钠粉末的总质量及恰好完全反应时所得溶液中溶质的质量分数。
过氧化钠是常用的供氧剂,可将CO2转化为O2,其反应的化学方程式是:2Na2O2 + 2CO2=2Na2CO3 + O2。若有22g CO2参加反应,计算生成O2的质量。
为测定石灰石样品中碳酸钙的含量,小明取25 g石灰石样品与一定质量的14.6%的稀盐酸恰好完全反应,将反应所得混合物蒸干得到固体27.2 g(不含结晶水,假设样品中的杂质既不与稀盐酸反应)。试计算:
(1)参加反应的盐酸的质量。
(2)石灰石样品中碳酸钙的含量。
为测定某含有少量NaCl的纯碱晶体(Na2CO3•nH2O)样品的组成,做了如下实验:
根据实验数据进行计算,写出计算过程。
(1)样品中含有结晶水的质量是 克。
(2)原混合物中NaCl与纯碱晶体(Na2CO3•nH2O)的质量比 。
(3)化学式Na2CO3• nH2O中n= 。
汽车尾气系统中使用催化转化器,可降低CO、NO等有毒气体的排放,其反应化学方程式为:2CO+2NO催化剂2CO2+N2,当有5.6gCO被转化时,计算同时被转化的NO的质量。
取含Na2CO3和NaCl的样品34g放在烧杯中并加入稀盐酸146g,恰好完全反应,此时,烧杯内溶液的总质量为175.6g。
计算:反应后所得溶液的溶质质量分数。
钛(Ti)和钛合金是21世纪的重要金属材料。钛可通过如下反应制得:
计算:要制得96g钛,需要镁的质量。
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如下图所示: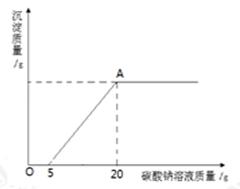
根据题中有关信息和图像分析回答下列问题:
(1)原废液中的溶质成分有_____(用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物10g,继续加热至完全反应后(固体质量不再变化时)固体变为9.04g,再将固体加水充分溶解、过滤、干燥得到1.59g黑色固体。求10g剩余固体混合物中氯元素的质量分数为
| A.7.1% | B.35.5% | C.28.4% | D.42.6% |
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 |
t1 |
t2 |
t3 |
t4 |
t5 |
| 烧杯和药品质量/g |
516.6 |
507.8 |
m |
503.4 |
503.4 |
请计算:(反应方程式为:BaCO3 + 2HCl = BaCl2 + H2O + CO2↑)
(1)表中的“m”为。
(2)该产品中碳酸钡的质量分数。
(3)当产品中碳酸钡与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数。
某化工厂生产的氧化亚铜(Cu2O)产品中常含有10%的金属铜。现准备用40 t该产品生产10%的硫酸铜溶液。已知:Cu2O+H2SO4===CuSO4+Cu+H2O
求:所需溶质质量分数为20%的稀硫酸质量和加水的质量。