铁元素缺乏是目前最严重的营养问题之一。乙二胺四乙酸铁钠(C 10H 12O 8N 2FeNa)是常用的补铁剂,其晶体性质稳定,易溶于水。20℃时,其1%的水溶液pH约等于4.下列关于乙二胺四乙酸铁钠的说法正确的是( )
| A. |
20℃时,其1%的水溶液显酸性 |
B. |
由五种元素组成 |
| C. |
性质稳定,易溶于水是其物理性质 |
D. |
该补铁剂可预防甲状腺肿大 |
"艾叶香,香满堂;粽子香,香厨房。"据研究,粽子的香味源于粽叶的主要成分﹣﹣对乙烯基苯酚(化学式为C8H8O)。下列说法正确的是( )
| A. |
对乙烯基苯酚不属于有机物 |
B. |
对乙烯基苯酚由3种元素组成 |
| C. |
对乙烯基苯酚中C.H.O三种元素的质量比为8:8:1 |
D. |
对乙烯基苯酚由8个C原子、8个H原子、1个O原子构成 |
2020年6月23日,我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用。
(1)铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝的 (填“高”或“低”)。
(2)写出铝与稀盐酸反应的化学方程式 ,其反应类型是 。
(3)室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的 (填“强”或“弱”)。
(4)卫星发射过程中使用偏二甲肼(C2H8N2)和四氧化二氮作为推进剂。在C2H8N2中,碳、氢元素的质量比为 。
人体所需的维生素C(化学式为C 6H 8O 6)主要从蔬菜、水果中摄取,计算:
(1)维生素C中碳、氢、氧三种元素质量的最简整数比为 。
(2)现有溶质质量分数为1%的维生素C的溶液300g,若配制成溶质质量分数为0.3%的维生素C的溶液,问需要加水的质量是多少。(写出计算过程)
某工厂利用废铁屑与废硫酸反应制取绿矾(FeSO4•7H2O)。
(1)绿矾中铁原子与氧原子个数比为 。
(2)现有废硫酸4.9t(硫酸的质量分数为20%)与足量的废铁屑反应,理论上可生产出绿矾的质量是多少?(请写出计算过程,结果保留三位有效数字,下同)
(3)若配制100g质量分数为20%的稀硫酸溶液,需质量分数为98%的浓硫酸的体积是多少?(已知:质量分数为98%的浓硫酸的密度为1.84g/cm3)。
新冠肺炎疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行手和其他皮肤的消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8g/mL,水的密度约为1.0g/mL)。
请回答下列问题:
(1)H2O的相对分子质量为 ,H2O分子中H原子与O原子的个数比为 。
(2)乙醇由 元素组成,配制乙醇消毒液需要乙醇和水的体积比为 。
(3)乙醇消毒液中乙醇的质量分数约为多少?(要求写出计算过程,结果精确到0.1%)

2019 年 5 月湖南省第七届矿博会在郴州市隆重举行,展厅上展出了各种矿物,其中有一 枚黑色的陨石引起了大家的兴趣。查阅资料获知,陨石的主要成分是铁和铁的化合物。
(1)通常情况下碳粉和铁粉都是黑色,检验碳粉中是否含有铁粉既可用物理方法又可 用化学方法:
①物理方法是 ;
②化学方法是 。
(2)常见铁的氧化物有 FeO、Fe 2O 3、 。(填化学式)
(3)铁制品在潮湿的空气中易生锈,实际上是铁与空气中的氧气、 等发生化 学反应的过程,请举出一例防止铁制品锈蚀的方法 。
实验员小明取一小块陨石进行了研究,研究过程如图所示:
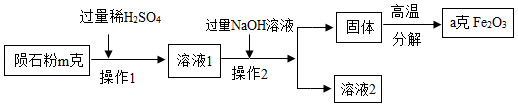
(4)图中操作 2的名称是 。
(5)溶液2中的溶质是 。(写化学式)
(6)陨石中含铁元素的质量分数为 。
氢氧化镍是某种混合动力汽车电池的一种材料。镍原子结构示意图为Ni
(1)镍原子最外层电子数是 ;
(2)氢氧化镍的化学式为 ,从组成上看,它属于 (选填"氧化物"、"酸"、"碱"、"盐"),预测该物质能与稀硫酸发生反应。
(3)按实验方案设计的路径,寻找两物质发生反应的证据。
查阅资料:①氢氧化镍:蓝绿色微溶于水的固体
②硫酸镍溶液呈绿色
③碳酸镍:浅绿色难溶于水的固体
| 路径 |
步骤 |
现象 |
结论 |
| 反应物角度 |
取少量氢氧化镍(新制)悬浊液于试管中,向其中滴加过量稀硫酸,振荡 |
① |
氢氧化镍和稀硫酸反应的化学方程式 ④ |
| 生成物角度 |
② |
③ |

实验室常用石灰石(主要成分的化学式:CaCO 3)与稀盐酸反应制取二氧化碳.某化学兴趣小组为了探究反应后废液中的成分,将废液过滤,取滤液40g于烧杯中,向其中滴加溶质质量分数为10.6%的碳酸钠溶液直到过量.有关变化如下图所示,根据题中有关信息和图象分析回答下列问题(石灰石中所含杂质不与稀盐酸反应,也不溶于水).
(1)CO 2由 种元素组成.
(2)每个CO 2分子中含有碳、氧原子的个数比为 .
(3)CO 2的相对分子质量是 .
(4)A点处生成沉淀的质量是 g.
(5)计算A点处溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).

葡萄糖(C6H12O6)溶液与银氨溶液[主要成分是Ag(NH3)2OH]反应,可以在玻璃表面均匀地镀上一层银,工业上可用于制镜,该反应为:C6H12O6(葡萄糖)+2Ag(NH3)2OH C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题.
C6H15O7N(葡萄糖酸铵)+2Ag↓+3NH3↑+H2O.请回答以下问题.
(1)葡萄糖分子中碳、氢、氧三种原子个数比为 ,碳元素的质量分数为 .
(2)若制镜需要用银21.6g,列式计算需要葡萄糖的质量.
泡腾片配料表如下:
成分 |
柠檬酸 |
碳酸氢钠 |
维生素C |
乳糖 |
色素香精 |
每片含量(4 g/片) |
未知 |
未知 |
0.2 g |
未知 |
极少量 |
泡腾片放入温开水中,浮于水面上,产生大量气泡,所得溶液喝起来酸甜可口。已知:柠檬酸的化学式为C6H8O7,相对分子质量为192;泡腾片溶于水时,碳酸氢钠刚好与柠檬酸完全反应,生成Na3C6H5O7。
(1)泡腾片在水中产生气体的化学式为 。泡腾片中柠檬酸与碳酸氢钠的质量比为 。
(2)称取5.00 g泡腾片放入200.00 g温开水中,待泡腾片完全溶解,不再产生气体后,测得溶液质量为203.68 g.通过计算确定泡腾片中柠檬酸的质量分数。
有一袋已部分变质的Ca(OH) 2(含杂质CaCO 3)固体样品,把该样品投入足量水中,充分搅拌后通入二氧化碳,沉淀质量与反应的二氧化碳质量关系如图所示。【提示:CO2+Ca(OH)2=CaCO3↓+H2OCO2+CaCO3+H2O=Ca(HCO3)2】
请回答下列问题
(1)Ca(OH) 2由 元素组成,其中H元素与O元素的原子个数比为 ;
(2)碳酸钙(CaCO 3)的相对分子质量为 ;
(3)生成沉淀最多时,参加反应的气体质量为 g;
(4)计算样品中碳酸钙的质量分数。(要求写出计算过程,结果精确到0.1%)
