手机常用的电池是锂电池。小华同学对锂(Li)元素产生了兴趣,他查看了元素周期表,发现锂是金属单质,原子结构示意图是 。他想了解如果把锂排到金属活动性顺序中应该放在什么位置,于是他去请教老师,老师让他比较锂与镁和锂与钠的金属活动性。于是他针对锂、镁、钠的金属活动性提出猜想。
【提出猜想】猜想一:锂、镁、钠的金属活动性是锂>钠>镁。
猜想二:铝、镁、钠的金属活动性是钠>锂>镁。
猜想三:锂、镁、钠的金属活动性是钠>镁>锂。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| 将体积一样大的锂块和镁块分别加入相同浓度的盐酸中 |
锂与盐酸反应更剧烈,产生气体速率更快 |
锂 (填">"或"<")镁 |
写出锂与盐酸反应的化学方程式:
【理论探究】小华同学认为钠和锂的金属活动性不需要实验也能判定,因为结构决定性质,他研究了钠和锂的原子结构示意图后认为锂 (填">"或"<")钠,理由是 。
【讨论交流】综合实验和理论探究,可以得出猜想 成立。同学们对原子结构示意图进行深入研究,发现从原子结构示意图可以推出元素的化合价,知道金属元素无负价。还可以利用化合价来判定氧化还原反应,化学反应中有元素化合价升降的就一定是氧化还原反应。下列反应就是氧化还原反应,已知水中的氢元素和氧元素的化合价没有变化。
A(单质)+H 2O=B(化合物)+C(化合物)
请回答:A是 (填"金属"或"非金属")单质,原因是 。
根据下列所给信息回答:
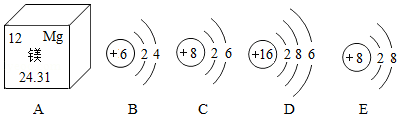
(1)A元素的原子序数是 ,C元素在形成化合物时的常见化合价是 ,与C元素化学性质相似的是 (填字母序号,下同),属于同种元素不同微粒的是 .
(2)常温下单质为气态的是 (填化学式).
(3)在上述元素中,两元素间能形成三原子分子,此化合物常温下是一种易挥发的无色液体.试推断这种化合物的化学式并说明理由: .
氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容。
(1)如图氧原子结构示意图获得的信息,正确的是 (填标号)。
a. 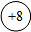 表示原子核,带8个单位正电荷
表示原子核,带8个单位正电荷
b.氧原子核外有2个电子层,有8个电子在核外作高速运动
c.氧原子在化学反应中易失去电子形成离子(O 2 ﹣)
(2)构成氧气的微粒是 ,氧气经降温和加压变为液态氧后体积变小,用微粒的观点解释: 。
(3)水是重要的氧化物,电解水实验说明水是由 组成的。登山和潜水供氧装置中,过氧化钠(Na 2O 2)与水反应,生成氢氧化钠(NaOH)和氧气,有关反应的化学方程式为 。
(4)自然界中氧循环的环节之一:绿色植物的光合作用,有关的化学方程式为6CO 2+6H 2O C 6H 12O 6+XO 2,则X= ,绿色植物通过光合作用将太阳能转化为 能。
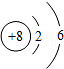
X、Y、Z、W是初中化学常见的四种非金属元素.X的一种原子没有中子,Y的一种单质可用于制铅笔芯,Z是地壳中含量最高的元素,W2是空气中含量最高的单质.回答下列问题:
①Y的另一种单质是天然存在的最硬的物质,该单质的名称为 ,Z2﹣的离子结构示意图为 .
②X、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为 .
③实验室检验YZ2时发生反应的化学方程式为 .
④钠与Z形成的化合物Na2Z2常用作潜水艇中的供氧剂,因为Na2Z2与YZ2反应生成Na2YZ3和Z2,写出其反应的化学方程式 .
⑤X、Y、W三种元素可按质量比2:6:7形成一种的火箭燃料偏二甲肼,其相对分子质量为60,偏二甲肼在空气中完全燃烧的产物均无污染,其化学方程式为
.
化学使我们的生活丰富多彩,生活中处处有化学。请用化学知识回答下列问题:
(1)画出O 2 ﹣的结构示意图 。
(2)浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,然后再涂上3%﹣5%的 (填名称)的溶液。
(3)乙醇 (填"能"或"不能")导电。
(4)干冰 (填"是"或者"不是")冰。
(5)电解水时加少量NaOH以增强导电性。但电解过程中NaOH不发生反应。则电解后溶液的pH (填"增大"、"减小"或者"不变")。
(6)氧化钙与水反应、镁与盐酸反应均 (填"放出"或"吸收")热量。
在元素周期表中,氯元素的信息如图所示,由图可知:x= ,在化学反应中氯原子容易 (填"失去"或"得到")电子而变成 (填化学符号).

(1)请用化学符号填空:
①氨分子: ;②3个镁离子: .
(2)如图1为某元素的原子示意图,请据此回答:

③该元素的元素符号为 ;
④该元素位于元素周期表中的第 周期.
(3)如图2是一定条件下,某化学变化的微观示意图,请据图回答问题:
⑤SO 2分子中S、O元素原子的质量比为 ;
⑥S 2 ﹣的核外有 个电子;
⑦写出该反应的化学方程式 .
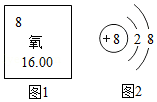
如图1是氧元素在元素周期表中的相关信息,图2是该元素形成的一种粒子的结构示意图.
(1)在元素周期表中,氧元素的原子序数为 .
(2)图2所示粒子为 (填“离子”或“原子”).
(3)由氧元素组成的一种气体单质可以支持燃烧,写出实验室制取该气体的一个化学方程式 .