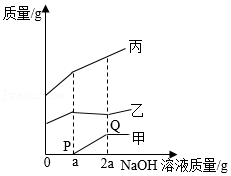
向盛有CuSO 4和H 2SO 4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如图所示。下列说法错误的是( )
| A. |
乙代表溶质质量 |
| B. |
Q点溶液中溶质为Na 2SO 4 |
| C. |
O→P过程反应的化学方程式为2NaOH+H 2SO 4═Na 2SO 4+2H 2O |
| D. |
原溶液中CuSO 4和H 2SO 4质量相等 |
课堂上同学们利用甲图所示装置做过氧化氢制氧气的实验时,用带火星的木条检验氧气,带火星的木条很难复燃。于是老师将甲装置进行了改进,如乙图,带火星的木条较易复燃。(图中的铁架台均已略去)请回答: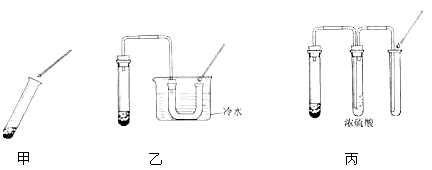
(1)写出实验室用过氧化氢和二氧化锰制取氧气的文字表达式:________________
二氧化锰在反应中作 剂,其作用是 ______。
(2)分析改用乙装置后,带火星的木条较易复燃的原因:______________________。
(3)老师又设计了另一个改进的丙装置,带火星的木条也易复燃。根据(2)推测的原因,分析浓硫酸的作用: 。
(4)你还能写出实验室用到二氧化锰制取氧气的文字表达式吗?_____________。
实验室制取氧气的装置如图所示,下列有关叙述合理的是
| A.锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水 |
| B.锥形瓶里加入高锰酸钾固体,分液漏斗里盛放蒸馏水 |
| C.集满氧气的集气瓶从水槽里取出后倒放在桌面上 |
| D.当发生装置中液体与固体一接触产生了气泡即刻收集 |
某同学设计了测定空气中氧气含量的实验,实验装置如图。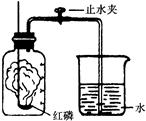
该同学的实验步骤如下:
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)该实验中红磷需稍过量,目的是 。
(2)步骤③中打开止水夹后观察到的现象是 ,由此可得出空气中氧气的体积分数约为 。
(3)该实验可推论出氮气__________(填“易”或“难”)溶于水和其化学性质________(填“活泼”或“不活泼”)的结论。
(4)若将红磷换成炭粉,该实验能否获得成功?为什么?
______________, 。
生活中常见物质的性质、制法的是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 (填"单质"或"化合物")。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 。
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
(4)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物。

①B装置玻璃管里可观察到的现象为 。
②C装置中反应的化学方程式为 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na 2CO 3溶液呈碱性)
(5)工业上可利用"铝热反应"焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?

小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她
设计并完成了下表所示的探究实验:
| |
实验操作 |
实验现象 |
实验结论或总结 |
|
| 结论 |
总结 |
|||
| 实验一 |
取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 |
有气泡产生,木条不复燃 |
过氧化氢分解产生氧气,但是 。 反应的化学方程式为: 。 |
二氧化锰是过氧化氢分解的催化剂 |
| 实验二 |
向盛水的试管中加入二氧化锰,伸入带火星的木条 |
没有明显现象 |
|
|
| 实验三 |
|
|
二氧化锰能加快过氧化氢的分解 |
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是: ;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作、现象和结论是: 。
小敏对紫黑色固体A进行相关实验,实验过程简化如下:
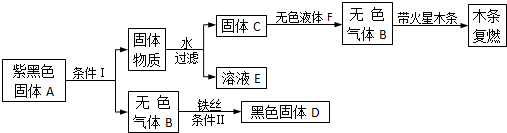
已知:A、B、C、D、E、F都是初中化学课本中已出现的物质,转化图中某些生成物已略去:
(1)A的化学式为 ,C的化学式为 ,
(2)请写出实验中一个氧化反应的化学方程式 。
取NaOH和NaCl的混合物3.63克放入烧杯中,加水溶解配制成70克溶液。向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2克时,溶液的pH 7(填“>”、“<”或“=”);此时溶液中的溶质是 (填化学式)。
(2)当pH=7时,计算该溶液中溶质的质量分数。(写出计算过程)

回答下列问题。
(1)某兴趣小组参观火力发电厂,了解到废气中的SO2、NO2、CO、CO2会影响环境,设计如图流程处理废气。
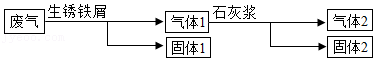
①用生锈铁屑处理废气中的CO,体现CO 性。
②用石灰浆不用石灰水的原因是 。
③固体2中有 (写两种物质)。
(2)A~D为初中化学常见物质,转化关系如图。A是由两种元素组成的钙盐,C是火力发电厂排放的温室气体。
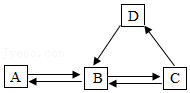
①B转化为A的化学方程式为 。
②若D广泛用于玻璃、洗涤剂的生产,则D转化为B的基本反应类型是 ;检验D中阴离子的方法是 。
③将足量C通入石蕊溶液中,现象是 ;测得该溶液pH=4,加热至90s时C完全排出,画出加热过程pH变化图像。
某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。
(1)配制溶液时,加速粗盐溶解的玻璃仪器是 。
【探究过程】
(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无
杂质;向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀CaCO3固体。反应的化学方程式为 。
(3)步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤;向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是 。
【初步结论】杂质成分已确定,且已完全除去。
【反思交流】
(4)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到 的现象,证明粗盐中确实存在Na2SO4。
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为 (填序号)。
A.Na2CO3溶液、BaCl2溶液
B.稀盐酸、BaCl2溶液
C.NaOH溶液、Na2CO3溶液
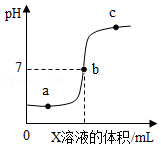
某学习小组进行盐酸与氢氧化钠的中和反应实验时,在常温下,向一定量的某溶液中滴加X溶液,得到了如图所示的pH变化曲线。下列说法正确的是( )
| A. |
X是盐酸 |
| B. |
向a点的溶液中加入硫酸铜溶液产生蓝色沉淀 |
| C. |
b点表示盐酸和氢氧化钠恰好完全反应 |
| D. |
c点溶液中的阴离子只有OH ﹣ |
粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程:
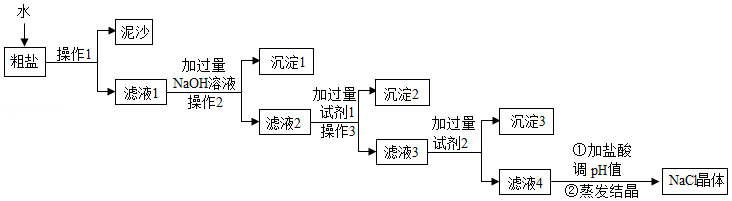
回答下列问题:
(1)操作1相当于实验室中的 操作;
(2)沉淀1的化学式为 ;
(3)加入过量试剂1的目的是 ;
(4)滤液4中含有的阴离子是 (填离子符号)。
我国在2017年"世界环境日"(6月5日)确定的主题是"绿水青山,就是金山银山".华雪与同学们积极参加了这一主题的活动,在老师的指导下,他们对一造纸厂排放的污水进行检测,发现其主要的污染物为NaOH.为了测定污水中NaOH的含量,他们首先把溶质质量分数为98%(密度1.84g/cm 3)的浓硫酸20g,稀释为质量分数为10%的硫酸;然后取80g污水于烧杯中,逐滴加入10%的硫酸至49g时恰好完全反应(假定污水中的其它成分不与硫酸反应).请计算:
(1)把20g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是 g.
(2)污水中所含NaOH的质量分数是多少?(写出计算过程)
(3)取80g该污水于烧杯中放置几天后,若其中的氢氧化钠全部转化为碳酸钠.则此时应逐滴加入10%的硫酸 克才能使碳酸钠恰好完全变成硫酸钠.
如图是一些物质间的转换关系(提示:二氧化锰不溶于水),请回答下列问题
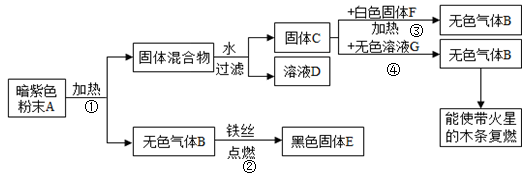
(1)写出下列物质的名称: B , C ,F ,G
(2)写出反应①的表达式: ;
(3)写出反应②的表达式: ,实验中预先加水的目的是
(4)固体C是反应③、④中的 ,在反应前后C的质量和 都不变。
下图所示的四个图像,能正确反映对应变化关系的是
| A.水的电解 |
| B.木炭在密闭的容器内燃烧 |
| C.加热一定量的高锰酸钾制氧气 |
| D.等质量的氯酸钾在有无二氧化锰条件下加热 |