金属材料在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)铁在初中化学实验中多次亮相,如图展示了铁钉的一系列变化。

I.变化①是铁钉与空气中的 发生了反应。
II.变化②中常见除去铁锈的化学方程式为 。
III.如表是小明同学记录的锌粉与稀硫酸反应过程中反应时间与产生气体体积的变化数据:
时间(min) |
1 |
2 |
3 |
4 |
5 |
氢气体积(mL) |
50 |
120 |
230 |
290 |
310 |
实验数据反映,该反应速率的特点是 ,引起该速率变化的原因是 。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,则反应后滤液中一定含有的溶质是 (填化学式)。
2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破.结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 .
(2)空气中,铝比铁具有更好的抗腐蚀性.原因是 (用文字叙述).
(3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性由强到弱的顺序是 .
某化学兴趣小组对金属的性质做了如下探究,请你帮他们完成下面的内容。
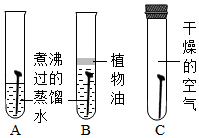
(1)探究铁生锈的原因(如图)(每支试管中均放有完全相同的洁净铁钉):
①一段时间后甲同学观察到: 试管中的铁钉明显生锈了。由此得出铁生锈的原因是铁与 共同作用的结果。
②为防止金属锈蚀,可以采取的措施有 (填一种)。
③在焊接铁制品前,常用稀盐酸清除其表面的锈,该反应的化学方程式是 。
(2)某同学分别向盛有形状、大小相同的铁片和锌片的试管中,倒入等质量、溶质质量分数相同的稀硫酸,以“ ”为依据来判断两种金属的活动性强弱。
(3)将一定质量的铁粉放入硫酸铜、硫酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是 ,所得滤液中一定含有的溶质是 (填化学式)。
小明去年暑假随父母到南方旅游.江南水乡,烟雨蒙蒙,别有一番风景.
(1)小明发现,南方的公交车铁质部件的锈蚀情况明显比银川的严重.他感到奇怪,但很快就明白了,原因是江南地区的 ,铁更易锈蚀.钢铁材料锈蚀会造成很大损失,写出一个在常温下除铁锈的化学方程式 .
(2)金属家族有众多“兄弟”.把形状、大小相同的铁、铜、铝三种洁净的金属,分别放入溶质质量分数相同的稀盐酸中,反应最为剧烈的金属是 ,不反应的是 ,这反映出不同金属的活动性差异很大.
(3)若要验证金属锌的活动性强弱在铝和铁之间,可选用 溶液,分别将铝和铁放入其中观察.写出其中能反应的化学方程式 .
金属材料广泛应用于生产生活中。
(l)铝块能制成铝箔是利用了铝的 性(填“导电”或“延展”)。
(2)为探究 铝、 铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是 (填字母)。
A.铝丝、铜丝、氯化镁溶液 B.铝丝、铜丝、硫酸铜溶液
(3)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示,回答问题。
①写出化学式:A ;B 。
②反应Ⅱ的化学方程式为 。
③反应Ⅲ的化学方程式为 。
(4)用1600t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为 t (结果保留至0.1)。

金属在日常生活,工农业生产和科学研究方面应用广泛.
(1)铜可用来制作导线,是因为其具有良好的延展性和 .
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 .
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验
实验序号 |
实验过程 |
实验现象 |
1 |
镁粉和铁粉分别与5%盐酸反应 |
镁粉产生气体快 |
2 |
铁粉和铁片分别与15%盐酸反应 |
铁粉产生气体快 |
3 |
铁片分别与5%盐酸和15%盐酸反应 |
15%盐酸产生气体快 |
由此得出影响金属与酸反应快慢的因素有:
a: b: c:
(4)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是 .
②若滤液为蓝色,则滤液中一定含有的金属离子是 (写离子符号)
下列是初中化学常见仪器与实验。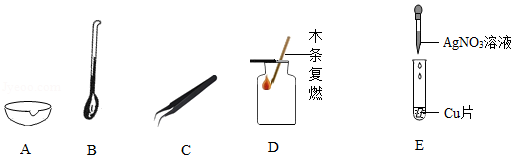
(1)A图中仪器的名称是 。
(2)取用块状大理石用到的是 (填字母)图中仪器。
(3)D图为检验氧气是否收集满的操作,请将明显的错误加以改正 。
(4)E图中能够说明Cu和Ag活动性顺序的现象是 。
某金属(用R表示)能与盐酸发生置换反应,其金属活动性弱于Zn,相对原子质量小于65.向一定质量的AgNO3、Cu(NO3)2和R(NO3)2混合溶液中加入Zn,充分反应后过滤,得到固体和溶液。向所得到的固体上滴加盐酸时有气泡产生。
(1)写出R与盐酸反应的化学方程式。
(2)所得到的固体中一定含有哪些金属?
(3)所得到的溶液的质量与原混合溶液的质量相比,可能增大,其原因是什么?
将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式。
(2)若所得溶液中只含有一种溶质,请分析所得固体的成分。
在Cu(NO3)2、Al(NO3)3和AgNO3的混合溶液中加入一定质量的锌粉,充分反应后过滤,向过滤后的溶液中滴加盐酸,无明显现象。则过滤后溶液中一定含有哪些溶质?请写出一定发生反应的化学方程式。
在一定质量Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入过量的Zn,充分反应后,过滤,可得到固体和溶液。
(1)请写出一个有关反应的化学方程式。
(2)向所得固体上滴加盐酸,能观察到什么现象。
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图。请回答:
(1)写出a点所发生反应的化学方程式 。
(2)d点对应的溶液中的金属离子有哪些?
(3)当加入锌的质量在bg~cg时,溶液的质量为什么会增加? 。

为了探究金属与酸反应的规律,某实验小组进行了如下实验,取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如图所示。
(1)请分析反应中温度升高的原因;
(2)根据曲线总结出金属活动性的相关规律。

铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关,
(1)用铜块制成铜片、铜丝利用了铜的 性。钢铁制品容易发生锈蚀,在其表面涂油漆的防锈原理是 。
(2)把两块大小相同且洁净的铁片、铜片分别投入浓度相同的稀硫酸中,请描述你观察到的现象并分析其中的原因。
(3)将纯铝和铝合金相互刻划,纯铝上留下明显划痕。请你解释其中的原因。
(4)自行车用到大量铝合金材料,外形美观,材质轻硬、牢固,除了代步,还可以作为健身工具。由此你对化学与人类生活的关系有何感想(任写一点)?
手机常用的电池是锂电池。小华同学对锂(Li)元素产生了兴趣,他查看了元素周期表,发现锂是金属单质,原子结构示意图是 。他想了解如果把锂排到金属活动性顺序中应该放在什么位置,于是他去请教老师,老师让他比较锂与镁和锂与钠的金属活动性。于是他针对锂、镁、钠的金属活动性提出猜想。
【提出猜想】猜想一:锂、镁、钠的金属活动性是锂>钠>镁。
猜想二:铝、镁、钠的金属活动性是钠>锂>镁。
猜想三:锂、镁、钠的金属活动性是钠>镁>锂。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| 将体积一样大的锂块和镁块分别加入相同浓度的盐酸中 |
锂与盐酸反应更剧烈,产生气体速率更快 |
锂 (填">"或"<")镁 |
写出锂与盐酸反应的化学方程式:
【理论探究】小华同学认为钠和锂的金属活动性不需要实验也能判定,因为结构决定性质,他研究了钠和锂的原子结构示意图后认为锂 (填">"或"<")钠,理由是 。
【讨论交流】综合实验和理论探究,可以得出猜想 成立。同学们对原子结构示意图进行深入研究,发现从原子结构示意图可以推出元素的化合价,知道金属元素无负价。还可以利用化合价来判定氧化还原反应,化学反应中有元素化合价升降的就一定是氧化还原反应。下列反应就是氧化还原反应,已知水中的氢元素和氧元素的化合价没有变化。
A(单质)+H 2O=B(化合物)+C(化合物)
请回答:A是 (填"金属"或"非金属")单质,原因是 。