硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
(1)某常见氮的氧化物中N、O两种元素的质量比为7:16,则该化合物的化学式为 。
(2)将该氮的氧化物23.0g与足量的氧气缓慢通入一定量水中(NO x+O 2+H 2O→HNO 3),得到60.0g硝酸溶液溶液的溶质质量分数为多少?(写出计算过程)
某兴趣小组取CaCO 3和CaCl 2的固体混合物7.5g,加入到盛有一定质量某浓度稀盐酸的烧杯中,恰好完全反应,气体全部逸出后,所得不饱和溶液的质量为41.8g。
烧杯及烧杯内物质质量随反应时间变化如表。
| 反应时间 |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯及烧杯内物质质量 |
64 |
62.9 |
61.8 |
61.8 |
计算:
(1)生成CO 2的质量为 g。
(2)烧杯中原有稀盐酸的溶质质量分数是多少?
化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
[探究一]溶解过程中的能量变化
如图所示,同学们设计了不同的实验方案进行探究:

(1)实验一中的硝酸铵溶解后,溶液温度 (填"升高"、"降低"或"不变")。
(2)实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此小明得出"氢氧化钠溶于水时放出热量"的结论,你是否同意小明的结论并写出你的理由 。
[探究二]氢氧化钠的化学性质
如图所示,同学们用氢氧化钠溶液进行了下列实验,请分析并回答下列问题:

(1)A试管中观察到的现象是 。
(2)B试管中发生反应的化学方程式: 。
(3)C、D试管中均无明显现象。
①为了证明D中已发生化学反应,向该试管中再加入足量的 ,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)

整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。请写出步骤Ⅱ中所加试剂 。
[探究三]氢氧化钠的应用
(1)实验室中的应用
实验室中能用氢氧化钠溶液吸收的气体是 (填字母)。
a.二氧化碳
b.水蒸气
c.氯化氢
d.氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的 不同。
(2)工业中的应用
氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9t(H 2SO 4的质量分数为20%),可以处理的废水质量是 t。
结合化学方程式中的数据分析:若将等质量、等溶质质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,请判断溶液中一定含有的溶质,并简述你的判断理由: 。
取一定量的硫酸铵固体于烧杯中,加入100g氢氧化钠溶液,加热,恰好完全反应。反应后将溶液蒸干,得到7.1g固体。该反应的化学方程式为:(NH4)2SO4+2NaOH═Na2SO4+2H2O+2NH3↑.请计算:
(1)生成氨气的质量。
(2)氢氧化钠溶液中溶质的质量分数。
取6.5g锌粒放入烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸的质量为50g。请计算:稀硫酸中溶质的质量分数。
实验室用34g过氧化氢溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)生成氧气的质量为 g。
(2)求所用过氧化氢溶液溶质的质量分数。(根据化学方程式进行计算,写出计算过程)
过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO 2),发生的化学反应为BaO 2+H 2SO 4═BaSO 4↓+H 2O 2,当恰好完全反应时生成23.3g沉淀。计算:
解:(1)设加入BaO 2的质量为X,生成的H 2O 2质量为Y,需要加入水的质量为Z
BaO 2 +H 2SO 4 ═BaSO 4↓+H 2O 2
169 233 34
X 23.3g Y
X=16.9g;Y=3.4g
(2)反应后所得溶液中溶质质量分数为: 6.8%;
(3)设需加入水的质量为Z
(16.9g+56.4g﹣23.3g)×6.8%=(16.9g+56.4g﹣23.3g+Z)×3%
Z=63.3g
答:(1)加入BaO 2的质量是16.9g;
(2)反应后所得溶液中溶质质量分数6.8%;
(3)需加入水的质量63.3g。
在100g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl═HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7g的AgCl沉淀,求盐酸的溶质质量分数。
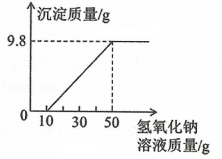
向盛有100g稀硫酸和硫酸铜混合溶液的烧杯中滴加氢氧化钠溶液至过量,过滤、烘干并称量沉淀的质量。该反应过程如图所示。请按要求回答问题:
(1)滤液中的溶质是 (填化学式)。
(2)计算原混合溶液中硫酸铜的质量。
(3)氢氧化钠溶液的溶质质量分数。
某工厂利用废硫酸溶液与铁反应制取硫酸亚铁。49t废硫酸溶液中的硫酸与5.6t铁恰好完全反应。求:
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。[温馨提示:Fe+H2SO4═FeSO4+H2↑]
某同学用质量分数为15%的稀硫酸处理某造纸厂含NaOH的碱性废水样品:
(1)用9.2g质量分数为98%的浓硫酸能配制上述稀硫酸 g(计算结果保留整数)。
(2)若上述造纸厂废水75g能与9.8g 15%的稀硫酸恰好反应(设只发生NaOH与硫酸的反应),试计算该废水中NaOH的质量分数(写出计算过程,结果精确到0.1%)。
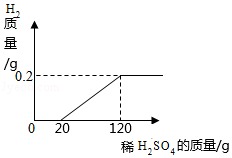
向表面生锈的铁片中滴加稀硫酸,产生氢气的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)从图中可以看出完全反应后产生氢气的质量为 g。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
某化学兴趣小组的同学进行了如图所示实验。

请根据图示信息计算:
(1)实验中产生氢气的质量是 g。
(2)实验中所用稀硫酸溶质的质量分数是多少(要求书写计算过程)?