我市沿海地区大量养殖贝类海产品,贝壳中含有的碳酸钙是重要的工业原料。为了测定某种贝壳中碳酸钙的含量,取贝壳样品25.0g放入烧杯中,分五次加入稀盐酸,每次充分反应后称量(杂质不与稀盐酸反应),所加入稀盐酸的质量与烧杯中物质的质量的关系如下表:
|
加入稀盐酸的总质量(g) |
25.0 |
50.0 |
75.0 |
100.0 |
125.0 |
|
烧杯中物质的总质量(g) |
47.8 |
70.6 |
93.4 |
116.2 |
141.2 |
计算:
(1)当加入盐酸的总质量为50.0g时,充分反应后生成的气体质量是 g。
(2)该贝壳样品中碳酸钙的质量分数。
硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
|
反应前 |
反应后 |
|||
|
实验数据 |
烧杯和过氧化氢溶液的质量/g |
硫酸铜溶液的质量/g |
烧杯和烧杯中溶液的质量/g |
|
|
60 |
3.3 |
62.5 |
||
(1)生成氧气的质量为 g.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
小黄同学为了测定某Cu﹣Ag合金中各金属的含量,取这种合金4.8 g与AgNO3溶液反应,加入AgNO3溶液的质量m与充分反应后所得固体的质量b的关系如图所示.请计算:
(1)AgNO3溶液中溶质的质量分数(结果精确 至0.1%);
(2)该合金中银和铜的质量比(结果精确至0.1).

某钢铁厂实验室为测定赤铁矿Fe 2O 3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:

请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 ;
(2)样品中Fe 2O 3的质量分数是 ;
(3)根据已知条件列式求解200g稀硫酸中溶质质量(x)的比例式 ;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为 ;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁,则理论上日产含杂质5%的生铁的质量为 .
大理石是含杂质的碳酸钙,因具有美丽花纹而被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。

(1)取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑,杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是 。
(2)反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克。实验后,根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量。
(3)请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)
(4)计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大会对实验结果造成较大影响,其原因是 。
工业生产常用"苛化法"制取氢氧化钠。其原料为碳酸钠、石灰乳[由Ca(OH) 2和水组成的混合物],大致流程如图1。

科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
(1)实验室进行"操作1"时,需要用到下列器材(图2)中的 (可多选)。
(2)制备氢氧化钠的化学方程式为,Na 2CO 3+Ca(OH) 2=2NaOH+CaCO 3↓.将53克溶质质量分数为20%的碳酸钠溶液与17克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的溶质质量分数。(写出计算过程,计算结果精确到0.1%)

洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl.HCl的含量可通过已知溶质质量分数的NaHCO 3溶液来测定,其它成分均不参与反应。请完成HCl与NaHCO 3反应的化学方程式:HCl+NaHCO 3=NaCl+ +CO 2↑。
(2)配制一定溶质质量分数的NaHCO 3溶液,需要用到的玻璃仪器有烧杯、滴管和 。
(3)向一锥形瓶中加入100克该品牌的洁厕灵,再逐次加入相同质量分数的 NaHCO 3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入NaHCO 3溶液的质量/g |
40 |
40 |
40 |
40 |
40 |
|
反应后溶液的总质量/g |
138.9 |
177.8 |
216.7 |
255.6 |
295.6 |
试分析计算下列问题:
①第一次实验时,所加 NaHCO 3溶液中溶质质量是多少克?
②该品牌洁厕灵中HCl的质量分数是多少?
海洋是一个巨大的宝库,从海水中得到的食盐不仅可作调料,还可作化工原料。氯碱工业就是以电解食盐水为基础的,化学方程式为:2NaCl+2H 2O  Cl 2↑+H 2↑+2NaOH.某科学兴趣小组模拟氯碱工业,将一定浓度的氯化钠溶液通电一段时间(只发生上述反应),收集到0.02克H 2.停止通电,向所得溶液中加入10克盐酸后,溶液恰好为中性。求:
Cl 2↑+H 2↑+2NaOH.某科学兴趣小组模拟氯碱工业,将一定浓度的氯化钠溶液通电一段时间(只发生上述反应),收集到0.02克H 2.停止通电,向所得溶液中加入10克盐酸后,溶液恰好为中性。求:
(1)电解过程中消耗氯化钠的质量。
(2)所加盐酸中溶质的质量分数(用化学方程式计算)。
徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
|
稀盐酸的用量 |
剩余固体的质量 |
|
第一次加入10g |
3.0g |
|
第二次加入10g |
2.0g |
|
第三次加入10g |
l.0g |
|
笫四次加入10g |
0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是 g。
(2)10g稀盐酸能与 g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1% )。
汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请按要求填空.(1)汽车制造中用得最多的金属材料是钢.钢 (填"是"或"不是")纯金属.车体表面喷漆不仅美观,而且可有效防止钢铁与 接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为 .
(2)汽车电路中的导线大都是铜芯的,这主要是利用了铜的 性.将赤铜矿(主要成分Cu 2O)和辉铜矿(主要成分Cu 2S)混合焙烧可得到铜,请将反应的方程式补充完整:2Cu 2O+Cu 2S  6Cu+ .
6Cu+ .
(3)铁、铜、铝三种因素在地壳中的含量多少顺序为Al>Fe>Cu,但三种金属被人类发现和利用的时间是铜最早,而铝最晚,这跟它们的 有关.铝具有很好的抗腐蚀性能,原因是 .
(4)镁铝合金是汽车制造中的重要材料之一.为测定某镁铝合金(只含镁、铝两种元素)的组成成分,某学习小组取3.9g合金粉末加入100.0g过量的盐酸中,向充分反应后的溶液中加入过量20.0%的氢氧化钠溶液,最终得到沉淀2.9g.
【质疑】通过讨论,大家认为得到的沉淀质量数据可能有问题.按初中化学现有知识计算,沉淀的质量至少为 g.
【探讨】经向老师请教,同学们了解到氢氧化铝沉淀可与氢氧化钠溶液反应,产生可溶性的偏铝酸钠,反应如下:NaOH+Al(OH) 3═NaAlO 2+2H 2O
【计算】若已知产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示,请计算:
①该合金中镁的质量为 g;铝的质量为 g.
②加入的盐酸溶质质量分数为多少?(请写出计算过程)

某兴趣小组用熟石灰中和实验室用含有硫酸的废水,向100g该废水样品中加入7.4g熟石灰,恰好完全反应(废水中的其它物质不参与反应).
(1)请完成该反应的化学方程式:H 2SO 4+Ca(OH) 2═CaSO 4+ .
(2)计算该废水中H 2SO 4的质量分数(写出计算过程)
为测定某黄铜(铜、锌合金)中铜的质量分数,某同学取20g黄铜样品放入盛有200g稀硫酸的烧杯中,恰好完全反应(铜与稀硫酸不反应),测得烧杯中剩余物质的总质量为219.8g,试计算:
(1)生成氢气的质量 g.
(2)该黄铜样品中铜的质量分数,所用稀硫酸的溶质质量分数.(写出计算过程)
向盛有26.4g硫酸钠和碳酸钠混合物的烧杯中加入218g稀硫酸,恰好完全反应,固体全部消失,烧杯内物质总质量减少了4.4g。(化学反应方程式为Na 2CO 3+H 2SO 4═Na 2SO 4+H 2O+CO 2↑),请计算:
(1)原混合物中碳酸钠的质量。
(2)反应后所得溶液中溶质的质量分数。
某市售某浓盐酸试剂瓶标签上的有关数据如图1所示。小张同学取5mL该浓盐酸加入锥形瓶中,加水稀释后,再逐滴滴加溶质质量分数为5%的NaOH溶液,反应过程中溶液的酸碱度变化如图2所示。
(1)小张同学所取的5mL浓盐酸的质量为 克。
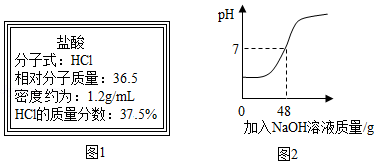
(2)通过计算,判断该浓盐酸中HCl的质量分数是否与试剂瓶标签上的数据相符(需要计算过程,计算结果精确到0.1%)