甲、乙两种物质溶解度曲线如图所示。下列叙述不正确的是( )

A.t3℃时,在100g水中加入20g甲,形成不饱和溶液
B.t2℃时甲、乙溶解度相同
C.甲、乙饱和溶液由t3℃降至t1℃,甲质量分数下降,乙质量分数升高
D.乙溶解度随温度的升高而降低
一杯热硝酸钾溶液放在桌面上,一段时间后观察到烧杯底部有少量的晶体析出,如图所示。忽略水的蒸发,下列关于硝酸钾及其溶液的分析正确的是( )

A.溶液质量不变
B.溶液的溶质质量分数变小
C.硝酸钾的溶解度变大
D.原溶液一定是饱和溶液
关于如图所示实验的相关判断错误的是( )

A.固体X可能是NaOHB.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>②D.Ca(OH)2质量分数:①=③
NaCl和KNO 3的溶解度曲线如图所示,下列说法正确的是( )

| A. |
KNO 3的溶解度一定大于NaCl |
| B. |
NaCl的溶解度受温度影响的程度比KNO 3大 |
| C. |
40℃时,KNO 3饱和溶液的溶质质量分数为63.9% |
| D. |
将60℃时210g KNO 3饱和溶液降温至20℃,析出KNO 3晶体78.4g |
下列图象不能正确反应对应关系的是( )
A.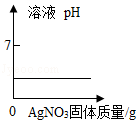 向盐酸溶液中加入少量AgNO3固体(忽略溶液体积变化)
向盐酸溶液中加入少量AgNO3固体(忽略溶液体积变化)
B.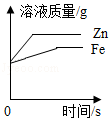 将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中
C.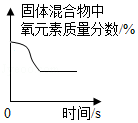 加热KClO3(加入少量MnO2)固体混合物制取O2
加热KClO3(加入少量MnO2)固体混合物制取O2
D.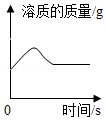 向饱和石灰水中加入少量生石灰
向饱和石灰水中加入少量生石灰
某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变
下列说法正确的是( )
A.溶质都是固体
B.乳化能增强乳浊液的稳定性
C.均一、稳定的液体是溶液
D.搅拌可增大物质的溶解度
甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,如图所示,下列说法正确的是( )

A.三种物质的溶解度都随温度的升高而增大
B.P点表示t2℃时甲、丙两物质的溶解度相等
C.t1℃时,乙物质的饱和溶液溶质质量分数为30%
D.甲中含有少量乙,可采用蒸发结晶的方法提纯甲
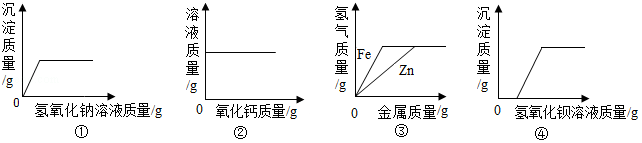
下列图象不能正确反映其对应实验操作的是( )
A.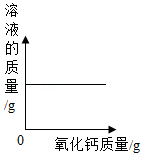 常温下向一定质量的饱和石灰水中加入氧化钙
常温下向一定质量的饱和石灰水中加入氧化钙
B.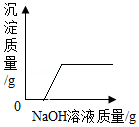 向H2SO4和CuSO4的混合溶液中滴加过量NaOH溶液
向H2SO4和CuSO4的混合溶液中滴加过量NaOH溶液
C. 向足量的锌粉、铁粉中分别加入等质量、等浓度的稀硫酸
向足量的锌粉、铁粉中分别加入等质量、等浓度的稀硫酸
D. 向氢氧化钠溶液中加入足量水
向氢氧化钠溶液中加入足量水
如图图象能正确表示对应叙述的有( )
①向一定量硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
②向一定量的饱和氢氧化钙溶液中加入氧化钙
③向等质量、等质量分数的稀盐酸中分别加入锌和铁
④向一定量的盐酸和硫酸钠的混合溶液中逐滴加入氢氧化钡溶液
A.1个B.2个C.3个D.4个
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线。下列说法错误的是( )

| A. |
甲物质的溶解度受温度变化影响较大 |
| B. |
t 1℃时甲、乙两物质的溶解度相等 |
| C. |
乙物质中混有少量的甲,可用冷却热饱和溶液的方法提纯乙 |
| D. |
t 2℃时向100g水中加入70g甲物质充分搅拌后,所得的溶液是甲物质的饱和溶液 |
向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )

| A. |
可采用升温的方法使乙烧杯中剩余的固体溶解 |
| B. |
甲、丙烧杯中的溶液一定属于不饱和溶液 |
| C. |
乙、丙烧杯中溶质的质量分数相等 |
| D. |
蔗糖的溶解度随温度的升高而减小 |
下列图示与相应的文字描述完全符合的是( )
A.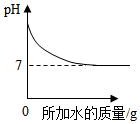 加水稀释NaOH溶液
加水稀释NaOH溶液
B. 加热分解KMnO4固体
加热分解KMnO4固体
C.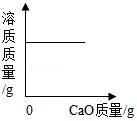 向饱和石灰水中加入CaO
向饱和石灰水中加入CaO
D.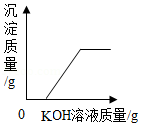 向稀硫酸和硫酸铜的混合溶液中加入KOH溶液
向稀硫酸和硫酸铜的混合溶液中加入KOH溶液
下列图示能正确反映对应变化关系的是( )
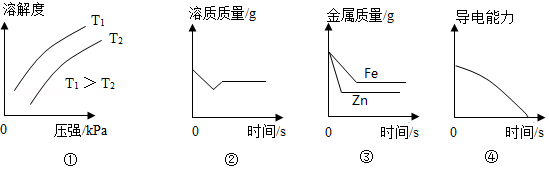
①CH4的溶解度与温度、压强的关系
②向Ca(OH)2饱和溶液中加少量CaO
③在等质量、等质量分数的两份稀硫酸中,分别加入过量的铁粉、锌粉(铁粉与锌粉质量相等)
④向稀硫酸中,逐滴加入与稀硫酸等质量、等质量分数的氢氧化钡溶液,测溶液的导电能力(离子浓度越大,溶液导电能力越强)
A.②③B.①②C.①④D.③④