图一是甲、乙两种固体物质的溶解度曲线,分析并回答问题。

(1)P点的含义是 。
(2)t2℃时,将甲、乙各30g分别加入到盛有50g水的两个烧杯中,充分溶解后,现象如图二所示。
①B烧杯中溶液的溶质是 (填“甲”或“乙”)。
②将B烧杯中的溶液全部倒入A烧杯中(甲和乙不反应),充分搅拌后,A烧杯中的固体 (填“全部溶解”“部分溶解”或“不溶解”)。
③欲使混合溶液恰好形成甲的饱和溶液,应再加入甲 g。
如图是甲、乙、丙三种物质的溶解度曲线。

(1)t 1℃时,三种物质的溶解度由大到小的关系为 。
(2)t 2℃时,甲、乙、丙三种物质的饱和溶液降温至t 1℃时为不饱和溶液的是 。
(3)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解②充分冷却后过滤③趁热过滤④加热蒸发至大部分晶体析出⑤加热蒸发至溶液接近饱和⑥停止加热用余热将溶液蒸干⑦用少量水洗涤晶体并烘干。合理的操作顺序为 (按顺序填编号)。
(4)t 3℃时,取等质量甲、乙、丙三种物质的饱和溶液,恒温蒸发一定质量的水(析出的晶体均不含结晶水),析出晶体的质量关系为甲=乙<丙,则剩余溶液的质量由大到小的关系为 。
(5)t 2℃时,配制甲、乙、丙三种物质的饱和溶液,一定相等的是 (填字母)。
A.溶质质量
B.溶剂质量
C.溶质质量分数
D.溶解度
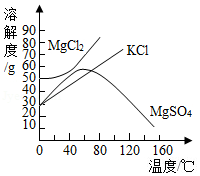
我市东临渤海,有着丰富的海洋资源,请思考下列问题
(1)已知东营盐场测得:①海水中含NaCl约为3.5%;②在海边打深井,井水中含NaCl约为8%.晒盐最好用 (填序号)作原料。
(2)关于晒盐原理的说法正确的是 。
A、利用阳光和风力,使水分蒸发,析出盐
B、日光照晒后,氯化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料,它们的溶解度曲线如图所示。
①60℃时,将50g;硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为 ,若使其形成饱和溶液,可采取的措施有 。
A、增加溶质 B、蒸发溶剂 C、升高温度 D、降低温度
②对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是 。
A、三种物质均为易溶物质
B、20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态。
C、60℃时,三种物质溶于水形成的溶液浓度可能相等。
甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )

| A. |
甲的溶解度大于乙的溶解度 |
| B. |
t 2℃时甲、乙的饱和溶液中溶质的质量分数相等 |
| C. |
t 1℃时乙的饱和溶液降温析出固体后变为不饱和溶液 |
| D. |
将t 2℃时甲、乙的饱和溶液降温到t 1℃,甲析出固体的质量大 |
下列有关溶液的叙述正确的是( )
| A. |
凡是均一稳定的液体一定是溶液 |
B. |
不饱和溶液一定是稀溶液 |
| C. |
增加溶质可使不饱和溶液变成饱和溶液 |
D. |
可溶性物质溶于水时一定会放出热量 |
根据KNO3和NaCl的溶解度曲线,回答下列问题:
(1)10℃时,溶解度较小的是 (选填“KNO3”或“NaCl”);
(2)根据溶解度曲线分析,从海水中获得粗盐不采用降温结晶方法的原因是 ;
(3)下列说法正确的是 。
A.将不饱和的KNO3溶液变为饱和,可采用加KNO3的方法
B.20℃时,KNO3和NaCl两种饱和溶液中,所含溶质质量NaCl大于KNO3
C.30℃时,溶质质量分数为20%的KNO3溶液甲,降温至20℃得到溶液乙,再降温至10℃得到溶液丙,三种溶液中溶质的质量分数大小关系:甲=乙>丙

如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
| 温度/℃ |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
| 碳酸钠 |
12.2 |
21.8 |
39.7 |
49.6 |
|
| A. |
20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液 |
| B. |
20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30% |
| C. |
两物质的溶解度曲线在20℃﹣30℃之间应出现交点 |
| D. |
可以采用降温结晶的方法从二者的混合物中提纯氯化钠 |
Na2SO4与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.加水能使NaCl溶液从不饱和变为饱和
B.20℃时,NaCl的溶解度比Na2SO4大
C.P点时,NaCl与Na2SO4的饱和溶液质量分数相等
D.将Na2SO4饱和溶液从30℃冷却至10℃,有晶体析出,溶液变为不饱和
下列表格为氯化钠和硝酸钾在不同温度时的溶解度。结合表中数据回答:
温度/℃ |
0 |
20 |
40 |
60 |
溶解度/g |
||||
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
硝酸钾 |
13.3 |
31.6 |
63.9 |
110 |
(1)在40℃时,硝酸钾的溶解度是 g。
(2)要使一定质量接近饱和的硝酸钾溶液变为饱和溶液,可以采用的方法是 。(写出一种)
(3)在20℃时,将24g氯化钠固体投入到50g水中,充分溶解后,所得溶液中溶质的质量分数是 。
如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )

A.a的溶解度大于b的溶解度
B.P点表示t1℃时a、c两物质溶解度相等
C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液
D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:b>a=c
如图为甲、乙、丙三种固体物质(不形成结晶水合物)在水中随温度变化的溶解度曲线,按要求填空。
(1)在 ℃时,甲和丙的溶解度相等。
(2)t1℃时,将乙溶液的状态由M点变为N点,方法是 。
(3)t3℃时,将40g甲放入50g水中,充分溶解后所得溶液的质量为 g。
(4)t3℃时,将125g丙的饱和溶液降温至t1℃,应再加入 g丙才能恰好达到饱和状态。

如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )

| A. |
使a、c的饱和溶液析出晶体都可以采用降温结晶的方法 |
| B. |
t 1℃时,a、c两种物质的溶液溶质质量分数一定相等 |
| C. |
t 2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是:a>b>c |
| D. |
在t 2℃时,将30g a物质加入50g水中充分溶解,所得溶液质量为80g |
甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答下列问题:
(1)P点表示的含义是 。
(2)t1℃时,将甲的不饱和溶液转化为该温度下饱和溶液的一种方法是 。
(3)t3℃时将90g甲的饱和溶液降温至t1℃,析出晶体的质量是 g。
(4)t3℃时,将等质量的三种物质的饱和溶液降温到t2℃,对所得溶液的叙述正确的是 (填字母序号)。
A.丙溶液的溶质质量分数不变 B.溶剂的质量关系是甲=乙>丙 C.溶液的质量关系是丙>乙>甲

某兴趣小组分别用加溶质和恒温蒸发溶剂的方法,将一定质量的硝酸钾不饱和溶液转化为饱和溶液。实验过程中,硝酸钾溶解度的变化情况分别是( )
A.变大 不变B.变大 变小C.不变 变大D.不变 不变