如表是NaCl和KNO 3在不同温度下的溶解度,有关说法不正确的是( )
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
| 溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
| KNO 3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
|
| A. |
NaCl的溶解度比KNO 3的溶解度大 |
| B. |
两种物质溶解度相等的温度在20℃~30℃之间 |
| C. |
20℃时,NaCl的溶解度为36.0g |
| D. |
60℃时,将11gKNO 3加入10g水中充分溶解,溶液刚好饱和 |
如表是NaCl、KNO 3的部分溶解度,请回答下列问题:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
| NaCl的溶解度/g |
35.8 |
36.0 |
36.63 |
36.6 |
37.0 |
37.3 |
| KNO 3的溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
(1)NaCl、KNO 3的溶解度受温度变化影响大的是 .
(2)20℃时,氯化钠的溶解度为 ,取20g氯化钠放入50g水里,充分搅拌,可得到溶液 g.
(3)如图所示进行操作(每步均充分溶解),可得到饱和溶液的有 (填字母),溶质质量分数最大的是 (填字母).

甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( )

| A. |
t 2℃,所得溶液都是饱和溶液 |
| B. |
t 1℃时,向50g水中加入甲可得80g饱和溶液,则乙在该温度下的溶解度为60g |
| C. |
甲中混有少量乙时,可用降温结晶的方法提纯甲 |
| D. |
t 2℃时,将等质量的甲、乙两种溶液分别降温到0℃,甲溶液的溶质质量分数一定小于乙溶液的溶质质量分数 |
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )

| A. |
操作I一定是降温 |
B. |
①与②的溶液质量一定相等 |
| C. |
①与③的溶质质量一定相等 |
D. |
②与③的溶质质量分数一定相等 |
某"天气瓶"通过樟脑在酒精溶液中的结晶情况反映气温变化。如图为该"天气瓶"在三种不同气温下的状况,则瓶内溶液一定为相应气温下樟脑饱和溶液的是( )

| A. |
甲、乙 |
B. |
甲、丙 |
C. |
乙、丙 |
D. |
甲、乙、丙 |
甲烧杯中盛有30℃、溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。

(1)乙中溶液 (填“是”、“不是”或“可能是”)饱和溶液。
(2)丙中溶液的溶质质量分数为 %(结果保留一位小数)。
20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )

| A. |
所得溶液可能都是饱和溶液 |
| B. |
20℃时,乙溶液的溶质质量最小 |
| C. |
溶液溶质的质量分数:甲>丙>乙 |
| D. |
升高温度,溶液溶质的质量分数一定变大 |
某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
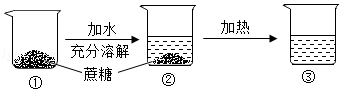
| A. |
②中溶液是饱和溶液 |
| B. |
③中溶液一定是不饱和溶液 |
| C. |
②③中溶液的溶质质量分数不相同 |
| D. |
③中溶液的溶质质量大于②中溶液的溶质质量 |
海水晒盐是海水在常温下蒸发得到氯化钠的过程.小柯用氯化钠溶液模拟该过程,如图:

(1)乙烧杯中的溶液 (选填"是"、"不是"或"可能是")氯化钠饱和溶液
(2)要加快氯化钠晶体析出,可以采用的方法是 .
如表是不同温度下KNO3的溶解度表。
温度(℃) |
0 |
20 |
40 |
溶解度(g/100g水) |
13.3 |
31.6 |
63.9 |
(1)称取30g KNO3固体时,在加一定量的KNO3固体后,发现托盘天平指针偏右,接下来的操作是 ,直到天平平衡;
(2)20℃时,将30g KNO3固体加入到盛有100g水的烧杯中,所得溶液是否饱和? ;
(3)要使20℃时的KNO3不饱和溶液变成饱和溶液,可采用 的方法。(写一种即可)
在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:

(1)最终甲、乙两烧杯中溶液一定是饱和溶液的是 。
(2)乙溶液在加50mL水的过程中,下列这些量逐渐减小的是 。
①溶解度 ②溶质质量分数 ③溶剂的质量 ④溶液的密度
某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
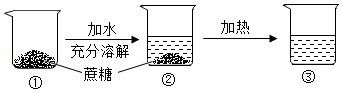
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示。则下列说法正确的是( )
温度/℃ |
10 |
30 |
50 |
70 |
90 |
溶解度/g |
27.7 |
39.3 |
49.0 |
54.1 |
51.1 |
A.硫酸镁的溶解度随温度升高而增大
B.10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液
C.50℃时,100g的硫酸镁饱和溶液中溶质和溶剂的质量比为49:100
D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大
根据如图所示的溶解度曲线,判断下列说法正确的是( )
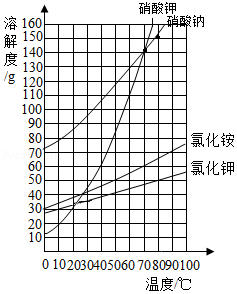
A.50℃时,分别将等质量的硝酸钾和氯化铵溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大
B.60℃时,把40g硝酸钾和40g氯化钾分别加入到50g水中,充分搅拌,降温至10℃,剩余晶体的质量氯化钾多
C.70℃时,50g硝酸钠饱和溶液与100g硝酸钾饱和溶液中所含溶剂质量之比为1:2
D.80℃时,向100g氯化钾饱和溶液中加入150g硝酸钠,充分搅拌后,最终得到250g溶液