乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
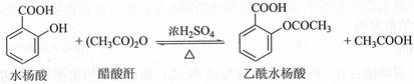
|
水杨酸 |
醋酸酐 |
乙酰水杨酸 |
|
|
熔点/℃ |
157~159 |
-72~-74 |
135~138 |
|
相对密度/(g·cm ﹣ 3) |
1.44 |
1.10 |
1.35 |
|
相对分子质量 |
138 |
102 |
180 |
实验过程:在 锥形瓶中加入水杨酸 及醋酸酐 ,充分摇动使固体完全溶解。缓慢滴加 浓硫酸后加热,维持瓶内温度在 左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
| A. |
热水浴 |
| B. |
酒精灯 |
| C. |
煤气灯 |
| D. |
电炉 |
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的________(填名称)。
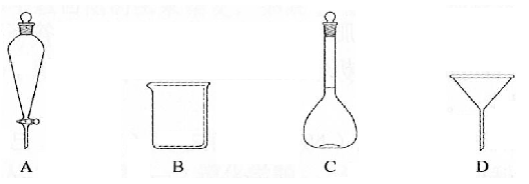
(3)①中需使用冷水,目的是________。
(4)②中饱和碳酸氢钠的作用是________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为________。
(6)本实验的产率是________%。
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
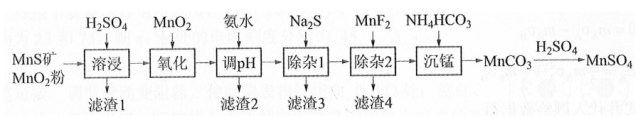
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
|
金属离子 |
|
|
|
|
|
|
|
|
开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
|
沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(K a约为10 −4, 易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
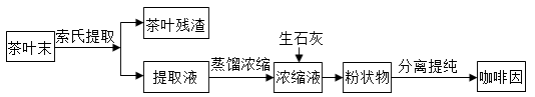
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
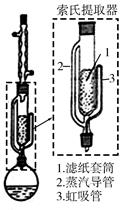
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒________。
(2)提取过程不可选用明火直接加热,原因是________,与常规的萃取相比,采用索氏提取器的优点是________。
(3)提取液需经"蒸馏浓缩"除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是________。"蒸发浓缩"需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是________ 和吸收________
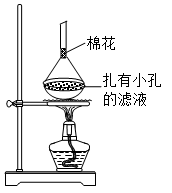
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________。
环戊二烯(  )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: 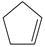 (g) =
(g) = 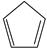 (g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
(g)+H 2(g) Δ H 1=100.3kJ·mol −1 ①
H 2(g)+ I 2(g) =2HI(g) Δ H 2=−11.0 kJ·mol −1 ②
对于反应:  (g)+ I 2(g) =
(g)+ I 2(g) = 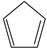 (g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(g)+2HI(g) ③ Δ H 3=________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( 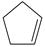 )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 K p=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
| A. |
通入惰性气体 |
B. |
提高温度 |
| C. |
增加环戊烯浓度 |
D. |
增加碘浓度 |
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
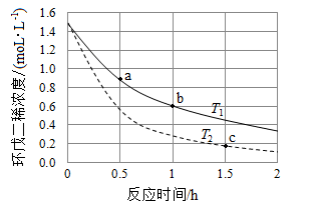
| A. |
T 1> T 2 |
| B. |
a点的反应速率小于c点的反应速率 |
| C. |
a点的正反应速率大于b点的逆反应速率 |
| D. |
b点时二聚体的浓度为0.45 mol·L −1 |
(4)环戊二烯可用于制备二茂铁(Fe(C 5H 5) 2结构简式为  ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
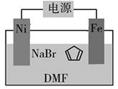

该电解池的阳极为________,总反应为________。电解制备需要在无水条件下进行,原因为________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
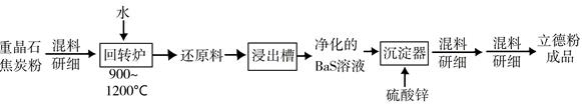
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
三氯氢硅(
)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 等,写出该反应的化学方程式________。
(2) 在催化剂作用下发生反应:
则反应 的 ________ 。
(3)对于反应 ,采用大孔弱碱性阴离子交换树脂催化剂,在 和 时 的转化率随时间变化的结果如图所示。
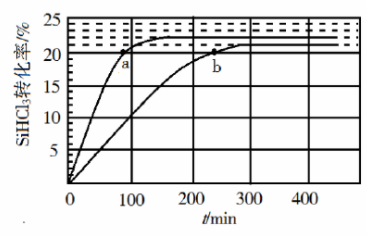
① 时反应的平衡转化率 α=________%。平衡常数 ________(保留2位小数)。
②在 下:要提高 转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小: ________ (填"大于""小于"或"等于")。反应速率 − , 、 分别为正、逆向反应速率常数, x为物质的量分数,计算a处 =________(保留1位小数)。
是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1) 的化学名称是________。
(2)利用" 氧化法"制备 工艺流程如下图所示:

"酸化反应"所得产物有 、 和 。"逐 "采用的方法是________。"滤液"中的溶质主要是________。"调pH"中发生反应的化学方程式为________。
(3) 也可采用"电解法"制备,装置如图所示。
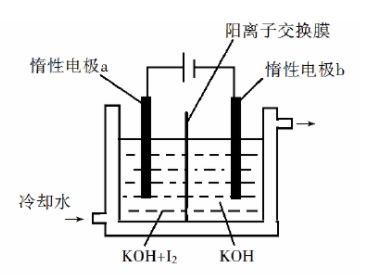
①写出电解时阴极的电极反应式________。
②电解过程中通过阳离子交换膜的离子主要为________,其迁移方向是________。
③与"电解法"相比," 氧化法"的主要不足之处有________(写出一点)。
硫代硫酸钠晶体(
)可用作定影剂、还原剂。回答下列问题:
(1)已知: , 。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀 、 溶液、 溶液、 溶液
(2)利用 标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取 某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至 的________中,加蒸馏水至________。
②滴定:取 的 标准溶液 ,硫酸酸化后加入过量KI,发生反应: 。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: 。加入淀粉溶液作为指示剂,继续滴定,当溶液________,即为终点。平行滴定3次,样品溶液的平均用量为 ,则样品纯度为________%(保留1位小数)。
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:
(1)晒制蓝图时,用 作感光剂,以 溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为________.
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
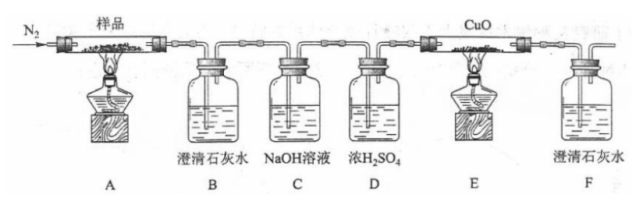
①通入氮气的目的是________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有________、________。
③为防止倒吸,停止实验时应进行的操作是________。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为________。
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有  和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子  形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为________。
(2)滤渣1的主要成分出 外还有________;氧化除杂工序中ZnO的作用是________.若不通入氧气,其后果是________。
(3)溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________;沉积锌后的电解液可返回________工序继续使用。
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. |
离子键 |
| B. |
σ键 |
| C. |
π键 |
| D. |
氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:
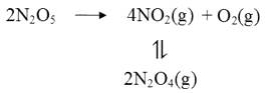
其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
|
t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
|
P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. |
ν(第一步的逆反应P>ν(第二步反应) |
| B. |
反应的中间产物只有 |
| C. |
第二步中 与 的碰撞仅部分有效 |
| D. |
第三步反应活化能较高。 |
醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
| A. |
404.4 |
| B. |
553.5 |
| C. |
589.2 |
| D. |
670.8 |
| E. |
766.5 |
(2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________.
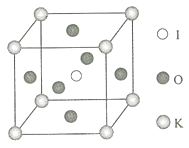
(3)X射线衍射测定等发现, 中存在 离子. 离子的几何构型为________,中心原子的杂化类型为________.
(4) 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为________nm,与K紧邻的O个数为________.
(5)在KIO 3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置.
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
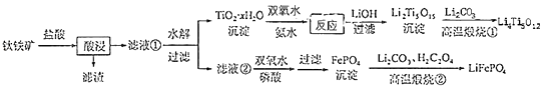
回答下列问题:
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
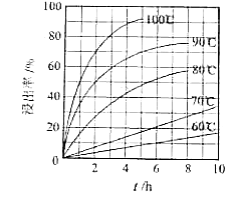
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
|
温度/℃ |
30 |
35 |
40 |
45 |
50 |
|
92 |
95 |
97 |
93 |
88 |
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.