下列离子方程式书写正确的是
| A.铁和稀硫酸反应:2Fe+6H+=2Fe3+ +3H2↑ |
| B.碳酸镁和盐酸反应:MgCO3+2H+= Mg2+ +CO2↑+H2O |
| C.铜和硝酸银溶液反应:Cu+Ag+=Cu2+ +Ag |
| D.硫酸镁溶液与氢氧化钡溶液反应: SO42-+Ba2+═BaSO4↓ |
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为
| A.3∶1 | B.1∶1 | C.2∶1 | D.1∶3 |
由CH4和O2组成的混合气体,标准状况下的密度为1.25g·L-1,则该混合气体中CH4和O2的体积比为
| A.2:1 | B.1:2 | C.1:3 | D.3:2 |
下列说法中不正确的是
| A.标准状况下,22.4L氦气含有所含的原子数约为6.02×1023 |
B.标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为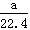 ×6.02×1023 ×6.02×1023 |
| C.22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同 |
| D.标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023 |
粗盐中含可溶性CaCl2、MgCl2及Na2SO4,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序可以是
| A.①②③④ | B.②③①④ | C.②①③④ | D.①③②④ |
在无色透明的溶液中,可以大量共存的离子组是
| A.MnO4-、Fe2+、K+、Cl- | B.Cu2+、Na+、Cl-、SO42- |
| C.Ca2+、Cl-、NO3-、K+ | D.Ca2+、H+、OH-、CO32- |
下列各溶液中,Na+物质的量浓度最大的是
| A.4L0.5mol/LNaCl溶液 | B.1L0.3mol/LNa2SO4溶液 |
| C.5L0.4mol/LNaOH | D.2L0.15mol/LNa3PO4 |
一定质量的铁和足量的稀硝酸或浓硝酸完全反应,在相同条件下,用排水集气法收集产生的气体。下列叙述一定正确的是
①硝酸浓度越大,消耗的硝酸越少 ②生成的Fe(NO3)3的物质的量相同 ③硝酸浓度越大,产生的气体越少 ④收集到的气体在相同状况下体积相同
| A.只有② | B.②④ | C.③④ | D.①②③ |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+)为0.2 mol·L-1 |
| B.上述电解过程中共转移0.2 mol电子 |
| C.电解得到的Cu的物质的量为0.05 mol |
| D.电解后溶液中c(H+)为0.2 mol·L-1 |
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是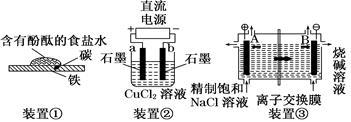
| A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e===Fe2+ |
| B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能 |
| C.装置③研究的是电解饱和食盐水,电解过程中B极上发生氧化反应 |
| D.三个装置中涉及的主要反应都是氧化还原反应 |
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e-=2CO32-,则下列推断正确的是
| A.负极反应为H2+2OH--2e-=2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
科研人员设想用右图所示装置生产硫酸,下列说法正确的是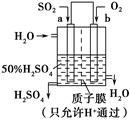
| A.a为正极,b为负极 |
| B.负极反应式为2H2O+SO2-2e-=SO42-+4H+ |
| C.电子从b极向a极移动 |
| D.生产过程中H+向a电极区域运动 |
将下图所示实验装置的K闭合,下列判断正确的是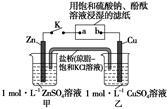
| A.Cu电极上发生还原反应 |
| B.电子沿Zn→a→b→Cu路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |