甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO (g) + 2H2(g)  CH3OH (g) △H 1 (反应1)
CH3OH (g) △H 1 (反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: △H2=-283 kJ·mol-1 (反应2)
△H2=-283 kJ·mol-1 (反应2) △H3=-242 kJ·mol-1 (反应3)
△H3=-242 kJ·mol-1 (反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1= 。
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g) ="=" CO2(g)+2H2O(g) △H4
O2(g) ="=" CO2(g)+2H2O(g) △H4
该反应的焓变△H4= 。
与CO和H2相比,甲醇作为汽车动力燃料的优点是 。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有 (写出3点)。既能提高产率,又能提高反应速率的措施是 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
下图中的均为有机物

据上图回答问题:
(1)的化学名称是。
(2)反应③的化学方程式是:(有机物须用结构简式表示)
(3)的分子式是:
的结构简式是反应的反应类型是
(4)符合下列3个条件的的同分异构体的数目有个
ⅰ)含有邻二取代苯环结构、 ⅱ)与有相同官能团、ⅲ)不与
溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)是的工业原料,用化学方程式表示
的一种的工业用途
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
0(填“>、<或= ”)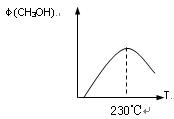
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A处为无水乙醇(沸点为78℃);B处为绕成螺旋状的细铜丝或银丝;C处为无水CuSO4粉末;D处为碱石灰;F处为新制的碱性Cu(OH)2悬浊液。 (1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为(填序号)_________________。E处是一种纯净物,其发生反应的化学方程式为____________。
(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为(填序号)_________________。E处是一种纯净物,其发生反应的化学方程式为____________。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是______________。D处使用碱石灰的作用是_________________。
(3)能证明乙醇反应后所生成的产物的实验现象是____________________。
(4)图中G处导管倾斜的作用是_____________________。
(5)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,B处发生反应的化学方程式是_______________________。
你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90号、93号换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。
| 1. |
燃料乙醇的生产过程可由下图表示:
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:。 |
| 2. |
到目前为止,我国已有上百个地市使用乙醇汽油。 |
| 3. |
右图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇()
|
| 4. |
除了燃料乙醇,二甲醚(CH3OCH3)和甲醇(CH3OH)也可作为汽车燃料,其中与乙醇互为同分异构体的是。 |
α-松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物:
可供选择的试剂:①Br2 ②H2 ③O2 |
请回答下列问题:
(1)试剂1是___________,试剂2是___________。
(2)A至H中,能发生银镜反应的是_____________________________。
(3)G和H的结构简式分别是:G__________________;H__________________。
(4)E转化为F的反应方程式是__________________________________________。
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8 g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式_______________;B可能的分子式_______________。
(2)若n(A)∶n(B)=1∶1时,A的名称_______________;B的名称_______________。
(3)若n(A)∶n(B)≠1∶1时,
A的结构简式为______________________________;
B的结构简式为______________________________;
则n(A)∶n(B)=______________________________。
某同学探究某有机物A的结构,进行如下实验:
①、取6.2克A在氧气中完全燃烧,将生成气体依次通过M(装有浓硫酸)和N(装有碱石灰)洗气瓶,M增重5.4克,N增重8.8克。
②、测定相对分子质量为62。
③、测定核磁共振氢谱,有两个强峰,比值为2:1
据此回答下列问题:
(1)②中测定相对分子质量的方法为 。
(2)12.4克A与足量钠反应生成气体的体积为 升(标准状况)
(3)A与乙酸反应的化学方程式 。
白藜芦醇 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是 mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是 mol。
1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
CH2=CH2

 HOCH2CH2CHO
HOCH2CH2CHO HOCH2CH2CH2OH
HOCH2CH2CH2OH
⑴通过反应①用乙烯和空气混合气体制备 ,测得反应前和某一时刻气体的体积分数如下表。
,测得反应前和某一时刻气体的体积分数如下表。
| |
C2H4 |
O2 |
N2 |
 |
| 反应前体积分数 |
25.0% |
15.0% |
60.0% |
0 |
| 某一时刻体积分数 |
5.56% |
5.54% |
66.7% |
22.2% |
计算此时乙烯的转化率。
⑵某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%。
计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?