如图是某同学设计的放热反应的观察装置。
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:
(1)实验中观察到的现象是 。
(2)该实验中在安装好装置后必须进行的第一步实验操作是 。
(3)实验中反应的化学反应方程式是 。
(4)说明CaO、H2O的能量之和 Ca(OH)2的能量。(填“>”、“<”或“=”)
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象? 。
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择.
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________
理由是 。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
| 直玻管质量m0/g |
直玻管与钙的质量m1/g |
直玻管与产物的质量m2/g |
| 14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= 。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式 。
(2)实验前必须对整套装置进行的操作是 。
(3)硬质玻璃管中石棉绒的主要作用是 。
(4)干燥管中盛装的物质可以是
(5)点燃酒精灯和酒精喷灯的先后顺序是
(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
为了证明有关物质的性质,某同学设计了如图所示的装置。当打开旋塞C,使A中液体与H中搁板上的固体B相遇时,即有气体产生,并发现D中的蜡烛慢慢熄灭;关闭C打开E时,则看到G中的蜡烛燃得更亮。请回答下列问题:
⑴请写出下列有关仪器的名称:A D
⑵请写出上图装置中有关仪器内盛放的物质的名称:A中 ,固体B ,固体F
⑶用化学方程式表示F中发生的有关反应(用双线桥表示其中之一反应的电子转移方向和数目).
、
(4)、写出H中反应的离子方程式
无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H2SO4(浓)===NaHSO4+HCl↑
(1)试剂X是 。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·nH2O中n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式 |
催化效果/g·g-1 |
| 1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
| 2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
| 3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
| 4 |
ω |
100 |
振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω= 。
(6)从实验1、2可以得出的结论是 。
(7)设计实验2、3的目的是 。
下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号) 。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 。
(3)写出B处的现象 。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由__________ _ _____。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_________________;
(3)该小组在步骤①中的错误是_____________ _ _______,由此造成的测定结果_________(填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______ ___ _;
(5)下图,是某次滴定时的滴定管中的液面,其读数为___________mL;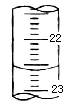
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.40 |
20.38 |
| 第二次 |
25.00 |
4.00 |
24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)
.某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
Ⅰ.装置B的作用 。
装置D的作用 。
Ⅱ.如何检验反应中是否有O2生成
。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: 。
(1)假设2的反应方程式为 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”),理由是 。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解, ,则假设3成立。(写明操作与对应的现象)
(I)为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计如下甲、乙两方案。
方案甲:实验1:取少量无水乙醚于试管中,加入少量金属钠。
实验2:各取3mL无水乙醚于试管中,分别加入少量等物质的量的苯酚和乙醇,再投入大小相同的钠块。
方案乙:
各取少量等物质的苯酚和乙醇于试管中,均在60℃的水浴加热,待苯酚熔化后,各放入相同大小的一小块金属钠。(已知:苯酚的密度为1.07g/mL)
(1)方案甲设计实验1的目的是 。
(2)方案乙中观察到:在乙醇中,钠很快与乙醇反应产生气体,溶液保持澄清;在苯酚中,钠块表面有少量气泡,且表面产生白色悬浮物,最后白色悬浮物充满苯酚熔融液。
①实验中观察到的白色悬浮物为 ;
②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有
____________。
(II)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
、 。
(2)甲和乙两个水浴作用不相同。甲的作用是 ;乙的作用是
(3)反应结束后,要检验a中乙醇催化氧化的生成物,可加入 浊液并加热,写出该反应化学方程式
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可在混合液中加入 (填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。
(1)硬质试管中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)装置E中的现象是 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于 后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同) 。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe ②Fe3O4和Fe ③只有Fe3O4 ④只有Fe
(6)另一份用___ (填仪器名称)加入 ,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是 (用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括 、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有 。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(9)试剂b的化学式是 ____。
(10)计算反应后B装置中铁元素的质量分数为 ;根据计算结果判断反应后硬质试管B中固体物质的成分是 。
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱。
【提出假设】
假设1: ; 假设2: ;
假设3:Fe2+和I-的还原性一样强。
【验证假设】
(1) 利用以下装置进行试验,
实验必需的装置是:A  (按氯气流向的顺序用序号书写)
(按氯气流向的顺序用序号书写)
(2)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。
(3)请 在下表中填写实验步骤及预期现象与结论。
在下表中填写实验步骤及预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 ; 向B试管中滴加 : |
① 若 则假设1成立 ② 若 则假设2成立 ③ 若 则假设3成立 |
(4)该实验成功的关键是控制各反应物的用量。该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过 。(标准状况)
(5)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小。并不能证明Fe2+和I-的还原性强弱。于是提出另一验证方案:往KI溶液中滴加 溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是 。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。
(1)仪器B的名称是__ ______。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________ 。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为___ _____,原因是___ _______________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为_________ _______。