下列用来表示物质变化的化学用语中,正确的是
| A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-= Fe2+ |
B.HS-水解的离子方程式:HS-+H2O S2-+H3O+ S2-+H3O+ |
C.CO32-水解的离子方程式:CO32-+2 H2O H2CO3 +2OH- H2CO3 +2OH- |
| D.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-===4OH- |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在水面处更容易腐蚀 |
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验 装置 |
 |
 |
 |
 |
| 部分实验现象 |
a极质量减小 b极质量增加 |
c极有气体产生 b极质量减轻 |
d极溶解c极有 气体产生 |
电流从a极 流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•xH2O),写出铁发生电化学腐蚀时正极的电极反应: 。
(3)下列哪个装置可防止铁棒被腐蚀 (填字母)。
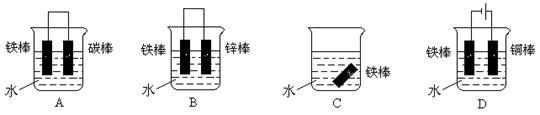

(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如右图,请回答:
① B电极对应的金属是 (写元素名称),A电极的电极反应式是 。
② 若电镀前两电极的质量相同,电镀完成后, 若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差 g。
对下图装置的叙述错误的是
| A.X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应。 |
| B.X如果是CuSO4,a和b分别连接直流电源正、 负极,一段时间后铁片质量增加。 |
| C.X如果是HCl,则不论a和b用导线连接还是 a和b分别连接直流电源的正、负极时,H+的移动方向均相同。 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程。 |
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B.脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.加入脱氧剂的目的是因为该反应是吸热过程,可降低温度,延长食品保质期 |
(16分)化学实验有助于理解化学知识,提升科学素养。
I.某探究小组用以下右图装置做如下实验。
| 实验编号 |
a中试剂 |
b中试剂 |
 |
| 1 |
0.1克Na、3 mL水 |
0.1克Na、3 mL乙醇 |
|
| 2 |
3 mL水 |
3 mL饱和FeSO4溶液 |
(1)实验1:同时加入试剂,反应开始阶段可观察到U形管中液面 (填编号,下同),反应结束静置一段时间,最终U形管中液面 。
a.左高右低 b.左低右高 c.左右基本持平
(2)实验2:一段时间后观察到U形管中液面左低右高, b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因: 。
II.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(3)请填满表中空格,以完成实验设计:
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸浓度/mol/L |
| ① |
作参照实验 |
0.5 |
2.0 |
1.0 |
| ② |
探究醋酸浓度对实验的影响 |
0.5 |
|
0.1 |
| ③ |
|
0.2 |
2.0 |
1.0 |
(4)实验①测得容器中的压强随时间的变化如图(2)所示。该小组得出0~t1时压强增大的主要原因是: 。t2时,容器中压强明显变小的原因是 。请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向。
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.导管内墨水液面回升时,正极反应式为:O2+2H2O+4e—==4OH- |
| D.U型管中溶液pH逐渐减小 |
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表。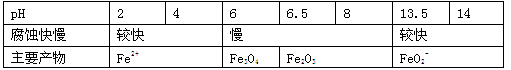
下列说法错误的是
| A.当pH<4时,碳钢主要发生析氢腐蚀 |
| B.当pH>6时,碳钢主要发生吸氧腐蚀 |
| C.当pH>14时,正极反应为O2 + 4H+ + 4e- =2H2O |
| D.将碱性溶液煮沸除去氧气后,碳钢腐蚀的速率会减缓 |
某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________.
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为________.
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________.
(4)丙组同学取10mL 0.1mol•L﹣1KI溶液,加入6mL 0.1mol•L﹣1 FeCl3溶液混合.分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红.
实验②检验的离子是________(填离子符号);实验①和③说明:在I﹣过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________.
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是________,生成沉淀的原因是________(用平衡移动原理解释).
右图装置中,U 型 管内为红墨水,a、b 试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )
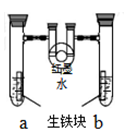
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-="==" Fe2+ |
| D.a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀 |
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
| A.溶液pH≤2时,生铁发生析氢腐蚀 |
| B.在酸性溶液中生铁可能发生吸氧腐蚀 |
| C.析氢腐蚀和吸氧腐蚀的速率一样快 |
| D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+ |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn—MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
有A、B、C、D四块金属片,进行如下实验,
①A、B用导线相连后,同时插入稀H2SO4中,A极为负极
②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D
③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡
④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,
则四种金属的活动性顺序为
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A