用石墨作电极电解1 mol·L-1下列物质的溶液,溶液的pH保持不变的是
| A.HCl | B.NaOH | C.NaCl | D.Na2SO4 |
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:

(1)M溶液可能是 (填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液 D. NaCl溶液 E.CuSO4溶液
(2)C极的电极反应式为 。
(3)滤纸丙的m端发生的现象为 。
(4)闭合K2、断开K1一段时间后,断开K2、闭合K1,若M溶液为KOH溶液,则A极电极反应式为 。乙池电解质溶液的pH________(填“增大”“减小”或“不变”)。
用石墨电极电解500 mL含一种溶质的某蓝色溶液,如右图所示,观察到A极表面有红色固体物质生成,B极上有无色气体生成;当溶液中的原有溶质完全电解后,取出A极,洗涤、干燥、称量,电极增重1.6 g,回答下列问题:
(1)B电极发生反应的电极反应式_______________________。
(2)写出电解时反应的离子方程式______________________________。
(3)电解后溶液中H+物质的量浓度为________________,要使电解后溶液恢复到电解前的状态,则需加入____________,其质量为________________。(假设电解前后溶液的体积不变)
(4)原溶液可能是________________溶液。
用石墨作电极电解100 mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+的物质的量浓度为
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
| A.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=H2↑ |
| B.断开K1,闭合K2时,OH-向b极移动 |
| C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| D.断开K2,闭合K1,一段时间后溶液的pH值要变大 |
如图两个电解槽中,A、B、C、D均为石墨电极。如果电解过程中共有0.02 mol电子通过,下列叙述中正确的是
A.甲烧杯中A极上最多可析出铜0.64 g
B.甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式为4H++4e-===2H2↑
根据下图所示的装置,判断下列说法正确的是
| A.该装置中a极为负极 |
| B.该装置中b极的电极反应式是:2H++2e-= H2↑ |
| C.一段时间后,左边装置中溶液pH增大 |
| D.CuSO4溶液浓度保持不变 |
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
下列说法正确的是( )

| A.图a中,随着电解的进行,溶液中c(H+)增大 |
| B.图b中,Mg电极做电池负极 |
| C.图c中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D.图d中,K分别与M、N连接,Fe电极均受到保护 |
利用图装置,可以完成很多电化实验。下列有关此装置的叙述中,不正确的是( )

| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量n(e—)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中正确的是( )
| A.电解前CuSO4溶液的物质的量浓度为2mol/L |
| B.电解后所得溶液中c(H+)=2mol/L |
| C.当n(e—)=0.6mol时,V(H2)∶V(O2)=3∶2 |
| D.向电解后的溶液中先后加入16gCuO和3.6g水,则溶液可恢复为电解前的浓度 |
用阳极X和阴极Y电解Z的水溶液,电解一小段时间后,再加入W能使溶液恢复到电解前的状态,符合题一组是( )
| 组号 |
X |
Y |
Z |
W |
| A |
C |
Fe |
NaCl |
盐酸 |
| B |
Pt |
Cu |
CuSO4 |
Cu(OH)2 |
| C |
Ag |
Fe |
AgNO3 |
Ag2O |
| D |
C |
C |
H2SO4 |
H2O |
BCl3是重要的化工原料,其沸点12℃。500℃时,向2L的密闭容器中按一定比例投入B2O3、C、Cl2,模拟工业制取三氯化硼的反应如下:B2O3(s) + 3C(s) + 3Cl2(g)  2BCl3 (g) + 3CO(g)。
2BCl3 (g) + 3CO(g)。
(1)反应起始至3min时固体质量减少了15.9克,则氯气的平均反应速率为_____________。
(2)反应至4min时达到平衡,则下列说法正确的是____________(填序号)。
A.3min时,CO的消耗速率大于氯气的消耗速率
B.2min至4min时BCl3的生成速率比0至2min时的快
C.反应起始至平衡,气体的密度不断增大
D.达到平衡后,容器内的压强不再变化
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
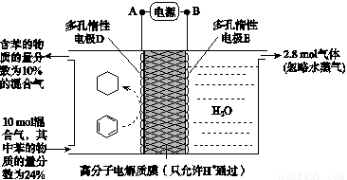
①A、D之间导线中电子移动方向为_______________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)