炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
① (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H1
CH3CH2CH2CH3(g) △H1
② (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H2
CH3CH2CH2CH3(g) △H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____;
| 温度(℃) |
300 |
320 |
340 |
| K1 |
4.8×10-4 |
2.5×10-4 |
1.3×10-4 |
| K2 |
8.4×105 |
3.5×103 |
1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______(用△H1、△H2表示)
 (g)
(g) 
 (g) △H
(g) △H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为______mol·L-1·min-1
②该温度下,此反应平衡常数K=_______(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________。
(1)在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是 (填序号字母)
a.0~t1时,v正>v逆 ,t2时,v逆>v正
b.混合气体的密度不再改变时,Ⅰ、Ⅱ两过程达到平衡
c.t2时刻改变的条件可以是向密闭容器中加C
d.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO2和0. 40 molNH3,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2) /mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①20 min时,平均反应速率υ (CO2 )= mol/L·min。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将 (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,
(3)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。当 V="44.8" L时,电池总反应方程式为 ;用该电池为电源,以石墨作电极,电解上述实验分离出的溶液,两极均产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是________________。
环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物(NOx)的仪器——动态库仑仪已获得实际应用。它的工作原理如下图所示。NiO电极上NO发生的电极反应式为 。
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术。压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)  2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)  N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H3= (用△H1和△H2表示)。
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①在NO2与CH4反应时,可提高NO2转化率的措施有 (填编号)。
A.增加催化剂的表面积
B.改用高效催化剂
C.降低温度
D.增大压强
E.分离出H2O(g)
F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容 积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图。
(4)SNCR是一种新型的烟气脱氮环保技术。在有氧条件下,其脱氮原理是:
NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示。图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条): 。
(17分)运用化学反应原理研究碳、氮、硫元素及其化合物有重要意义。
(1)已知一定量的C单质能在O2(g)中燃烧,其可能的产物及能量关系如图所示:
写出CO2(g)与C(s)反应生成CO(g)的热化学方程式_______________________。
(2)汽车尾气净化过程中发生反应2NO(g)+2CO(g) N2+2CO2(g) △H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
N2+2CO2(g) △H<0。一定条件下,向某密闭恒容容器中按体积比1:l充入44.8L(标准状况)NO和CO混合气体,发生上述反应,某同学根据反应过程中的有关数据绘制了如图所示曲线。
①下列关于上述反应过程的叙述正确的是 ________(填写字母代号)。
| A.其它条件不变,加入催化剂,△H的值不变 |
| B.及时除去二氧化碳,反应的正反应速率加快 |
| C.NO、CO、N2、CO2浓度均不再变化,说明平衡未发生移动 |
| D.混合气体的平均相对分子质量不再改变,证明反应达到化学平衡状态 |
②前10min内CO的平均反应速率为______,达平衡时NO的转化率为_____,能使上述平衡体系中 增大的措施有__________(任写一条)。
增大的措施有__________(任写一条)。
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表(单位省略):
| 弱电解质 |
H2CO3 |
H2SO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.2×10-7 Ka2=5.6×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
Kb=1.7×10-5 |
①室温条件下。用敞口容器加热氨水一段时间,恢复至室温后,溶液中水的电离程度比加热前_______(填写“增大”、“减小”或“不变”)了.
②常温下,0.1 mo1·L-1(NH4)2SO4溶液呈_____(填“酸”、“中”、“碱”)性。
③常温下,测得某碳酸饮料的pH=6,则该饮料 ________。
________。
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下: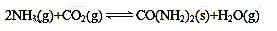
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。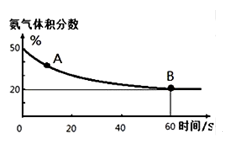
①A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
②关于上述反应的平衡状态下列说法正确的是________________
| A.分离出少量的尿素,反应物的转化率将增大 |
| B.平衡时再充入一定量NH3 (g),CO2的转化率增大 |
| C.NH3的转化率始终等于CO2的转化率 |
| D.加入有效的催化剂能够提高尿素的产率 |
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到 _______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ________0(填“>”“<”或“=”)
④第一步反应的△S ________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= _____________________;NH4+水解平衡常数值为______________。
运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
N2(g)+CO2(g) △H="Q" kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
 时间 时间浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q______0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是______(填选项编号)。
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:
NO+CO N2+CO2(有CO) 2NO
N2+CO2(有CO) 2NO N2+O2(无CO)
N2+O2(无CO)
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出C2H6与NO2发生反应的化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为 。
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
(13分)某条件下,在2 L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: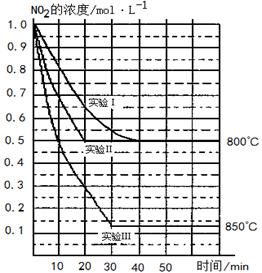
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= ,该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向 进行(填“正反应方向”或“逆反应方向”)。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,
如:8NH3+6NO2 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH="4.7" ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。














工业上可利用“甲烷蒸气转化法生产氢气”,反应为:
CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1 (水碳比为3) 图2 (800℃)
(1)CH4(g)+H2O(g)  CO(g)+3H2(g)。的
CO(g)+3H2(g)。的 H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是 。
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
(15分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________(用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) ="=" CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)
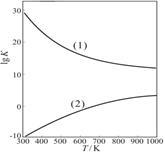
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是

A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c ( H2 )减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大 |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程

①写出阳极电极反应式 。
②请写出除去甲醇的离子方程式 。
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
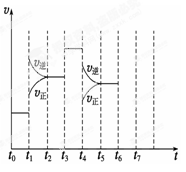
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):

(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g) CO2(g)+ H2(g)ΔH<0。
CO2(g)+ H2(g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
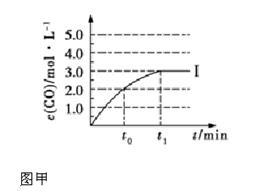
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。
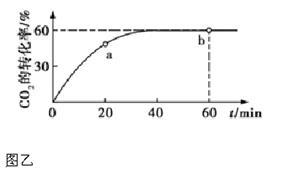
(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1的氨水,那么该氨水的pH= 。
(已知
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加
和
,即可得到
,该反应的还原产物为。
(2)上述浓缩液中含有
、
等离子,取一定量的浓缩液,向其中滴加
溶液,当
开始沉淀时,溶液中
为:,已知
=1.8×10-10,
=8.5×10-17。
(3)已知反应
的
,1
、1
分子中化学键断裂时分别需要吸收436
、151
的能量,则1
分子中化学键断裂时需吸收的能量为
。
(4)
研究了下列反应:

在716
时,气体混合物中碘化氢的物质的量分数
与反应时间
的关系如下表:
| 0 |
20 |
40 |
60 |
80 |
120 |
|
| 1 |
0.91 |
0.85 |
0.815 |
0.795 |
0.784 |
|
| 0 |
0.60 |
0.73 |
0.773 |
0.780 |
0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:。
②上述反应中,正反应速率为
正=
正·
,逆反应速率为
逆=
逆·
,其中
正、
逆为速率常数,则
逆为(以
和
正表示)。若
正 = 0.0027
,在
=40
时,
正=
③由上述实验数据计算得到
正~
和
逆~
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母)
