下列说法中不正确的是( )
| A.σ键比π键重叠程度大,形成的共价键强 |
| B.两个原子之间形成共价键时,最多有一个σ键 |
| C.N2分子中有一个σ键,2个π键 |
| D.气体单质中,一定有σ键,可能有π键 |
下列化学用语描述中正确的是
A.含18个中子的氯原子的核素符号: |
B.比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 |
C.HCO3-的电离方程式为:HCO3-+ H2O CO32-+H3O+ CO32-+H3O+ |
| D.次氯酸的结构式:H-Cl-O |
下列说法中,不正确的是( )
| A.双原子分子中的共价键,一定是极性键 |
| B.非极性键也可能存在于离子化合物中 |
| C.物理变化可能破坏化学键 |
| D.离子化合物在固态时不能导电 |
下列叙述错误的是( )
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4) |
下列关于化学键的说法中正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.由非金属组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子里 |
| D.不同元素组成的多原子分子里的化学键一定是极性键 |
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键
| A.①③⑤⑥ | B.②④⑥ | C.①②③⑤ | D.①③⑤ |
下列化合物中所有化学键都是共价键的是
| A.Na2O2 | B.NaOH | C.BaCl2 | D.CH4 |
有关化学用语的表示正确的是
A.甲烷分子的比例模型是 |
B.二氧化碳的电子式: |
C.Cl-的结构示意图为: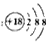 |
D.HClO的结构式为H—O—Cl |
下列微粒间的作用力中,不属于化学键的是
| A.分子间作用力 | B.金属键 | C.共价键 | D.离子键 |
关于下列反应,说法正确的是:(图中共有三种原子)
| A.反应过程中E中共价键断裂,G中共价键保持不动 |
| B.E中存在非极性键 |
| C.M分子有可能是HCl |
| D.上述反应的类型是加成反应 |
下列说法正确的是
| A.非金属单质中一定存在共价键; |
| B.金属元素和非金属元素形成的化合物一定是离子化合物; |
| C.含共价键的化合物不一定是共价化合物; |
| D.溶于水能导电的化合物就是离子化合物 |
下列表达方式错误的是
A.氢有三种核素:H、D、T B.S2-的结构示意图:
C.石英中存在SiO2分子 D.CO2分子的结构式:O=C=O
下列哪一组元素的原子间反应容易形成离子键
| 原子 |
a |
b |
c |
d |
e |
f |
g |
| M层电子数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
A.a和c B.c和g C.e和g D.b和g