A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是 _____________________________;将Y与等物的量的SO2充分混合后通入品红溶液,未见其褪色,原因是__________________________________________(请用化学方程式解释说明)。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶
液为某浓酸,则反应所得的氧化产物的化学式为 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,而且A可溶于X溶液中:
① A元素的元素符号为 ,则A与B的反应中氧化剂与还原剂的物质的量之比是 。
② 若含a mol X的溶液溶解了一定量A后,此时溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量为 mol(用含a代数式表示);为保证A与B充分反应后最终所得的溶液中同时含有上述两种金属阳离子,则此时B与A的质量比应满足的取值范围是 。
在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)

(1)B的化学式是
(2)A的电子式是
(3)已知气体F是一种漂白剂,写出D和F反应的化学方程式:
(4)写出反应II的离子方程式:
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化如下图所示(部分产物已略去)。
请按要求回答下列问题:
(1)若B、C 为氧化物,C能够与水反应生成一种强酸E。
①当B为无色易溶于水的刺激性气体时,写出B转化为C的化学方程式: ;
②当B为无色不溶于水的气体时, F由A与E化合生成。当小心加热F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目)和一种无色无味的液体H,写出F分解生成G和H的化学方程式 ;
(2)若D为氧化物,A、B、C都是强电解质,C可用于食品发酵、泡沫灭火。写出A与D反应的离子方程式: ;
(3)若D为强酸或强碱溶液时都能发生图示转化关系,且A和C在溶液中反应生成白色沉淀B。
当D为强酸时,A→B反应的离子方程式: ;
当D为强碱时,B→C反应的离子方程式: 。
(12分)从物质X出发有如下图所示的一系列变化。已知X为酸式盐,A、C为无色气体,反应的某些产物已经略去。
(1)写出下列物质的化学式:X:___________________________________________;
G:____________________。
(2)写出反应②的化学方程式:__________________________________________________。
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式:
_______________________________________________________________________。
(4)反应④中氧化剂与还原剂的质量之比为____________________________。
A、B、C、D均为中学化学常见物质,且含有一种相同的 元素,它们之间有如下转化关系,其中A是单质。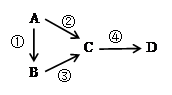
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式___________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式___________________________________。
下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
| A.具有丁达尔现象 |
| B.红褐色液体可用过滤的方法纯化 |
| C.液体中分散质微粒直径小于1nm |
| D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
I(10分):A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为___________(填元素符号)
(2)若D是金属,C溶液在储存时应加人少最D,其理由是(用必要的文字和离子方程式表示)_____ ___;
(3)若A、B、C为含同一种金属元素的无机化合物.在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子力程式__________________________________.
化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E的混合物投人500m1稀硫酸中,固体全部溶解并产生气体。待反应完全后.向所得溶液中加人NaOH溶液,生成沉淀的物质的是与加人溶液的体积关系如下图所示:
则固体混合物中Mg的质量为_____________;NaOH溶液的物质的量浓度为___________。
II(5分):某一离子反应体系有反应物和产物共以下六种:
MnO4—、H+、O2、H2O、H2O2、Mn2+
已知该反应中的H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是___________。
(2)该反应中.发生还原反应的过程是_____→_____。
(3)溶液随着酸性的增强氧化性不断增强,应选择__________(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(4)如反应转移了0.6mo1电子,则产生的气体在标准状况下体积为__________。
[化学--选修5:有机化学基础]
化合物G是治疗高血压的药物"比索洛尔"的中间体,一种合成G的路线如下:
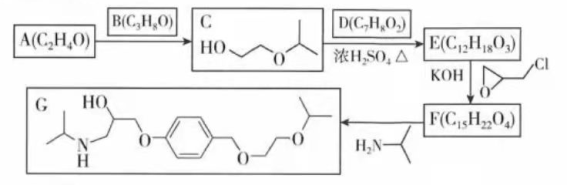
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢; 可与 或 反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G的分子式为____________。
(6)L是D的同分异构体,可与FeCl 3溶液发生显色反应, 的L可与 的 反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
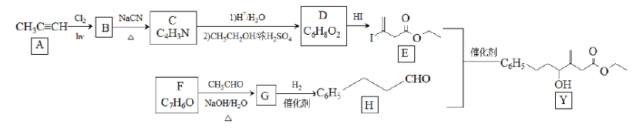
已知: 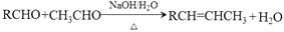
回答下列问题:
(1)A的化学名称是________。
(2)B为单氯代烃,由B生成C的化学方程式为________。
(3)由A生成B、G生成H的反应类型分别是________、________。
(4)D的结构简式为________。
(5)Y中含氧官能团的名称为________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________。
氰基丙烯酸酯在碱性条件下能快速聚合为 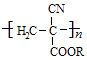 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
② 
回答下列问题:
(1)A的化学名称为________.
(2)B的结构简式为________.其核磁共振氢谱显示为________组峰,峰面积比为________.
(3)由C生成D的反应类型为________.
(4)由D生成E的化学方程式为________.
(5)G中的官能团有________、________、________.(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有________种.(不含立体结构)
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________。
下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。

请回答下列问题:
(1)D的电子式为__ ___。
(2)K的化学式为___ ___。
(3)写出B与C高温反应生成E和F的化学方程式:___ __。
(4)写出D与J的稀溶液反应生成G的离子方程式:__ ___。
(除标注外,每空2分,共8分)如下图所示:化合物A只含两种元素,C为白色胶状沉淀,B、F为刺激性气体,且F能使品红溶液褪色,E为金属单质,J、K为非金属单质,化合物H和L为常见化工产品,化合物I常温下为液态,H的浓溶液与K加热能生成F和无色无味气体M(图中反应条件和部分产物已略去)。

试回答下列问题:
(1)写出A、M的化学式:A_____;M__ _。
(2)写出反应①、②的化学方程式:
__ __;_ _ _。
(3)写出E→D反应的离子方程式:_ __。
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是_________;所含阴离子相同的两种盐的化学式是_____________。
(2)M的化学式为_______________,M溶液显碱性的原因是________________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是______________;N和氨水反应的离子方程式是__________________。
(4)若要检验Y中所含的阳离子,正确的实验方法是______________________。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______________;H ___________;G________;乙__________;
(2)写出下列反应的化学方程式
反应①____________________________________________。
反应②____________________________________________。