下列叙述正确的是( )
A.0.1 mol·L-1氨水中,c(OH-)=c(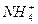 ) ) |
| B.0.1 mol·L-1NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中,c(Na+)=2c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.02 mol·L-1盐酸与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液的pH=13 |
在盐类发生水解的过程中正确的说法是( )
| A.盐的电离平衡被破坏 | B.水的电离程度逐渐增大 |
| C.溶液的pH一定发生改变 | D.抑制了水的电离 |
为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
| A.将CH3COONa·3H2O晶体溶于水,温度降低 |
| B.醋酸钠水溶液的pH大于7 |
| C.醋酸钠溶液滴入酚酞是红色,加热后颜色变深 |
| D.醋酸钠溶液与浓硫酸微热,可逸出醋酸蒸气 |
欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(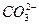 )、c(
)、c( )都减小,其方法是( )
)都减小,其方法是( )
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.加水稀释 | D.加入饱和石灰水溶液 |
物质的量浓度相同时,下列既能跟NaOH溶液反应、又能跟盐酸反应的溶液中pH最大的是( )
| A.Na2CO3溶液 | B.NH4HCO3溶液 |
| C.NaHCO3溶液 | D.NaHSO4溶液 |
向三份0.1 mol·L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
0.1 mol·L-1 NaHCO3的溶液的pH最接近于( )
| A.5.6 | B.7.0 | C.8.4 | D.13.0 |
在25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入 0.2 mol·L-1醋酸溶液,曲线如下图所示,有关粒子浓度关系比较不正确的是( )

A.在A、B间任一点(不包含A、B两点),溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(CH3COO-)>(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c( )+c(OH-)+c( )+c(OH-)+c( ) ) |
B.c( )>c(H2C2O4) )>c(H2C2O4) |
C.c( )+c( )+c( )="0.1" mol·L-1 )="0.1" mol·L-1 |
D.c(K+)=c(H2C2O4)+c( )+2c( )+2c( ) ) |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A.Na2CO3NaHCO3NaCl NH4Cl | B.Na2CO3NaHCO3NH4Cl NaCl |
| C.(NH4)2SO4NH4Cl NaNO3Na2S | D.NH4Cl (NH4)2SO4Na2S NaNO3 |
有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是( )
| A.CaO2的水解产物是Ca(OH)2和H2O2 |
| B.NaClO的水解产物之一是HClO |
| C.PCl3的水解产物是PH3和HClO |
| D.Mg3N2水解生成NH3和Mg(OH)2 |
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA- HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显_______(填“酸性”“中性”或“碱性”)。
理由是___________________________________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2A溶液中,下列粒子浓度关系式正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)="0.1" mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是0.11 mol·L-1_________ (填“<”“>”或“=”),理由是____________________________________。
(4)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:__________________________。
为了配制 的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
| A.①② | B.③ | C.③④ | D.④ |