25℃时,体积为Va、pH=α的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合后恰好完全反应。若Va>Vb,且α=0.4b,请填写下列空白:
(1)a可否等于2?(填“可”或“否”)__________。
(2)a可否等于4?(填“可”或“否”)__________。
(3)a的取值范围是_____________________。
(1)室温下PH=2的某强酸稀释100倍,PH=_____,PH=12的某强碱稀释100倍,PH=____
(2)室温下,PH=2的HCl与PH=12的氨水等积混合后,溶液的PH_ __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________
(3)室温下,0.01mol/L的HCl与0.01mol/L的氨水混合后,溶液的PH___7(填>,<或=),原因是_______________________________________________________________________
(4)室温下,将PH=5的H2SO4溶液稀释10倍C(H+):C(SO42-)=_________
将稀释后的溶液再稀释100倍,C(H+):C(SO42-)=_________
(5)MOH和ROH两种一元碱的水溶液分别加水稀释时,PH变化如右图:下列叙述中正确的是()
A:MOH是一种弱碱
B:在x点,MOH完全电离
C:在x点C(M+)=C(R+)
D:稀释前ROH溶液中C(OH-)是MOH溶液中C(OH-)的10倍
下列说法正确的是
| A.PH=2与PH=1的硝酸中c(H+)之比为 1:10 |
| B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| C.0.2 mol·l-1与0.1 mol·l-1醋酸中c(H+)之比为2:1 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_____ ___,
___, 通过计算确定上述方案________(填“可行”或“不可行”)。
通过计算确定上述方案________(填“可行”或“不可行”)。
常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL0.1000 mol·L-1CH3COOH溶液所得滴定曲线如右图.
下列说法正确的是 ( )
A.点 ①所示溶液中:c(CH3COO—) +2 c(OH—) = c(CH3COOH) + 2c(H+) ①所示溶液中:c(CH3COO—) +2 c(OH—) = c(CH3COOH) + 2c(H+) |
| B.点②所示溶液中:c(Na+)<c(CH3COO—) + c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(OH—)>c(CH3COO—)> c(H+) |
| D.滴定过程中可能出现: c(CH3COOH)>c(H+)>c(CH3COO—)>c(Na+)>c(OH—) |
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是
| A.滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(CH3COOH)>c (H+)> c(OH-) |
| B.点①所示溶液中酸的中和率大于50% |
| C.点②是二者恰好中和点 |
| D.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)>c (H+) |
已知 时,溶液的pH
时,溶液的pH 5.1,现用
5.1,现用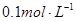 盐酸滴定20mL
盐酸滴定20mL 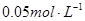 氨水,用甲基橙作指示剂,达到终点时所用盐酸的量是( )
氨水,用甲基橙作指示剂,达到终点时所用盐酸的量是( )
| A.10mL | B.5mL | C.大于10mL | D.小于5mL |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如下图所示.
mol/L,x与y的关系如下图所示.
请回答下列问题:
(1)此温度时,水的离子积Kw为 , 则该温度t 25℃(填“>”“<”“=”).
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L
与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
②若所得混合液的pH=2,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a。
已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
| A.将饱和氯水升温,继续通入Cl2时,溶液中c(H+)变化如曲线b |
| B.在饱和氯水中通入SO2气体,溶液中c(H+)变化如曲线c |
| C.降温,继续通人Cl2时,溶液中c(H+)增大 |
| D.在饱和氯水中加入NaOH使 pH=7,所得溶液中存在下列关系c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05m ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液
ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液 ,④pH=5的NH4NO3溶液中,发生电离的水的物
,④pH=5的NH4NO3溶液中,发生电离的水的物 质的量之比是( )
质的量之比是( )
| A.1:10:1010:109 | B.1:5:5×109:5×108 | C.1:20: 1010:109 | D.1:10:104:109 |
某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是( )
| A.该温度下,0.0l mol/L醋酸溶液的pH=4 |
| B.该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10 |
| C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 |
| D.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7 |
列说法中正确的是( )
| A.pH=10与pH=12的NaOH溶液等体积混和,溶液pH=11 |
| B.pH=5的盐酸溶液稀释1000倍,溶液的pH等于8 |
| C.pH=2的 H2SO4与pH=12的NaOH溶液等体积混和,溶液pH=7 |
| D.pH=12的NH3·H2O与pH=2的HCl溶液等体积混和,混和液pH=7 |
用水稀释0.lmol·L-1的氨水时,溶液中随着水量的增加而减小的是
A. |
B. |
| C.[H+]和和[OH-]的乘积 | D.OH-的物质的量 |