根据以下4个反应:
①H2S+I2=S↓+2I-+2H+,②SO2+2H2S=3S+2H2O,
③2I-+Br2=I2+2Br-,④SO2+I2+2H2O=H2SO4+2HI。
确定Br-、I-、H2S、SO2的还原性由强到弱的顺序是
| A.H2S>SO2>I->Br- | B.I->Br->SO2>H2S |
| C.H2S>I->Br-> SO2 | D.I->Br->H2S>SO2 |
常温下,在溶液中可发生以下反应:
①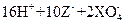 ===
===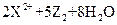 ,
,
②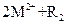 ===
=== ,③
,③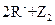 ===
=== ,
,
由此判断下列说法错误的是()
A.还原性强弱顺序为: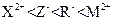
B.Z元素在反应①中被氧化,在③中被还原
C.常温下可发生反应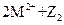 ===
===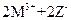
D氧化性强弱顺序为: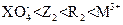
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
已知在酸性溶液中的还原性强弱顺序为:SO2 > I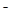 > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl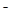 ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I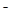 + Fe + Fe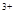 =I2 + Fe =I2 + Fe |
B.2Fe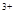 + SO2 + 2H2O=2Fe + SO2 + 2H2O=2Fe + SO + SO + 4H+ + 4H+ |
| C.SO2 + 2H2O + I2=H2SO4 + 2HI |
| D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O |
下列物质的变质过程中,既有氧化还原反应,又有非氧化还原反应的是()
| A.Ca(ClO)2 | B.NaOH | C.FeSO4 | D.Na2SO3 |
以下有水参与的化学反应都属于氧化还原反应,但水既不做氧化剂又不做还原剂的有。
①2Na2O2+2H2O=4NaOH+O2↑ ②Cl2+H2O="HCl+HClO"
③C+H2O=CO+H2④3NO2+H2O=2HNO3+NO
⑤2Na+2H2O=2NaOH+H2↑ ⑥2F2+2H2O=4HF+O2
现有下列反应,据两式判断,还原性由强到弱的排列顺序正确的是
(1)2Fe3++2I—2Fe2++I2(2)Cl2+2Fe2+2Fe3++2Cl—
| A.Cl—>Fe2+>I— | B.I—>Fe2+> Cl— | C.Cl—>I—>Fe2+ | D.Fe2+>I—> Cl— |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液。由于浓度不同而能发生不同氧化还原反应的是( )
| A.①③ | B.③④ |
| C.①② | D.①③④ |
在反应中3S+6KOH =2K2S+ K2SO3+3H2O,氧化剂与还原剂的质量之比是
| A.1∶2 | B.2∶1 | C.1∶1 | D.3∶2 |
在下列反应中,硫元素表现出还原性的是()
| A.稀硫酸与锌粒反应 | B.三氧化硫与水反应 |
| C.浓硫酸与铜反应 | D.二氧化硫与氧气反应 |
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。上述一系列过程中,最终被还原的是
| A.SO2 | B.Cl- | C.Fe3+ | D.NO |