雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。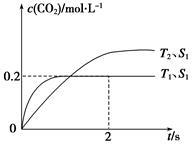
据此判断:
①该反应的ΔH__________0(填“>”或“<”),ΔS__________0(填“>”或“<”)
②在T1温度下,0~2 s内的平均反应速率v(N2)=____________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率__________(填“增大”,“减少”或“不变”)
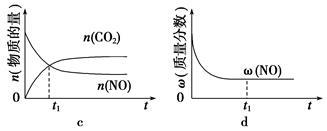
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填字母)。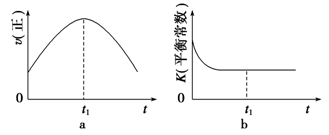
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867.0 kJ·mol-1
2NO2(g) N2O4(g)ΔH=-56.9 kJ·mol-1
N2O4(g)ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式_________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为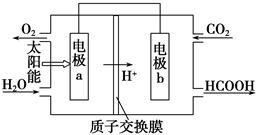
a:_________________________________________;
b:_________________________________________。
科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向 极移动;向外电路释放电子的电极是 。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的主要方向。
(1) “生物质”是由植物或动物生命体衍生得到的物质的总和。生物质能主要是指用树木、庄稼、草类等植物直接或间接提供的能量.秸秆、杂草等废弃物经微生物发酵之后,便可以产生沼气,利用沼气是解决人类能源危机的重要途径之一。下面说法不正确的是( )
| A.利用生物质能就是间接利用太阳能,生物质能是可再生能源 |
| B.生物质能是解决农村能源的重要途径之一 |
| C.生物质能的缺点是严重污染环境 |
| D.若建立沼气发电站,则可以实现把生物质能转化为电能 |
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为 -890.3 KJ·mol-1、-285.8 KJ·mol-1、-283.0 KJ·mol-1,则该重整的热化学方式为 ;
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:
C(s) +CO2(g ) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分 )=气体总压(P总 )×体积分数,则925℃时,用平衡分压代替平衡浓度表示的化学平衡常数= 。T℃时,若充入等体积的CO2和CO,平衡 (填“正向移动、逆向移动、不移动”)。


(4)如下图是一个二甲醚(CH3OCH3)燃料电池工作时的示意图,
①若乙池为粗铜的电解精炼,电解质为硫酸铜,则N电极材料为 。
②若乙池中M、N为惰性电极,电解质为足量硝酸银溶液,写出乙池中电解的化学方程式 。乙池中某一电极析出金属银2.16g时,溶液的体积为200mL,则常温下乙池中溶液的pH为 。
③通入二甲醚的铂电极的电极反应式为 。若该电池的理论输出电压为1.0V,则该电池的能量密度= kW·h·kg-1(结果保留小数点后一位).(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=9.65×l04C·mol-1 )。
美国科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50 W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电路中每通过5 mol电子,在标准状况下约有5.6 L丙烷被完全氧化 |
| C.通丙烷的电极为电池负极,该极发生的电极反应式为C3H8-20e-+10O2-===3CO2+4H2O |
| D.丙烷燃料电池的能量利用率比丙烷燃烧的能量利用率大 |
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示: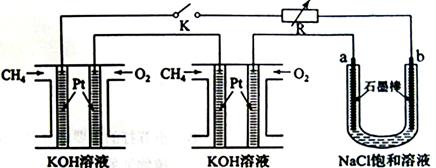
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 ;
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 ;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为
(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可),最多能产生的氯气体积为 L(标准状况)。
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是( )
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
B.电池放电时,负极反应为Fe+2O H--2e-=Fe(OH)2 H--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+OH-=NiOOH+H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH- 向正极移动 |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO32- |
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
| A.有O2参加反应的a极为电池的负极 |
| B.有H2参加反应的b极为电池的正极 |
| C.a极对应的电极反应式为O2 + 2H2O -4e = 4OH- |
| D.该电池的总反应方程式为:2H2+O2 = 2H2O |
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O

回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变______,当外电路通过1mol电子时,理论上负极板的质量增加 g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e—="=" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为Cu0/Zn0/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)若反应在恒温、恒压下进行,以下叙述能说明该反应达到平衡状态的是 。
| A.CO和H2的物质的量浓度比是1:2 |
| B.CO的消耗速率等于CH3OCH3的生成速率的2倍 |
| C.容器中混合气体的体积保持不变 |
| D.容器中混合气体的平均摩尔质量保持不变 |
E.容器中棍合气体的密度保持不变
(2)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(3)复合催化剂的制备方法之一是Na2 C03共沉淀法:制备1 mol/L的硝酸铜,硝酸锌和硝酸铝的水溶液。然后向盛有去离子水的烧杯中同时滴加混合硝酸盐溶液和1 mol/L的Na2C03水溶液,70℃下搅拌混合。沉淀后过滤,洗涤沉淀物,80℃下干燥12小时,然后500℃下焙烧16小时。请写出上述过程中硝酸铝与Na2C03水溶液反应的离子方程式:
(4)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。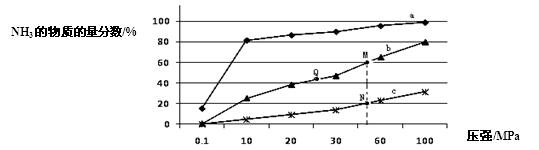
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
观察下列几个装置示意图,有关叙述不正确的是( )

| A.装置①中阴极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中a为负极,发生的电极反应式为H2+2OH﹣+2e﹣=2H2O |
| D.装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |