铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;当外电路通过1mol电子时,电解液中消耗H2SO4 mol。
(2)充电时,Pb 和电源的 极相连,此时发生的电极反应式为 。
(每空2分,共8分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)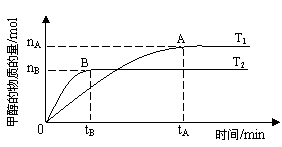
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
(10分)设计出燃料电池使天然气CH4氧化直接产生电流是对世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入天然气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)这个电池的正极发生的反应是: ;(2分)
(2)负极发生的反应是: ;(2分)
(3)固体电解质里的O2-的移动方向是: ;(2分)
(4)天然气燃料电池最大的障碍是氧化反应不完全,产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。(2分)
(5)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会__________(填“增强”、“减弱”或“不变”)。(2分)
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b表示) 。(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为 0.82g/cm3。用锂吸收 224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
燃料电池是目前正在探索的一种新型电池。它的工作原理是在燃料燃烧过程中将化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:X极:O2(g) + 4e- + 2H2O(l) ="==" 4OH-
Y极:H2(g)-2e- + 2OH- ="==" 2H2O(l)
(1)X极是电池的 极(“正”或“负” ),发生 反应(“氧化”或“还原” )反应。
(2)总的电池反应方程式
(3)若反应得到5.4g液态水,燃料电池中转移的电子为 mol
(7分)某同学用铅蓄电池作电源,用石墨作电极电解500mL某浓度的AgNO3溶液,观察到A电极表面有金属生成,B电极上有无色气体产生。当溶液中原有溶质完全电解后,停止通电,取出A极,洗涤、干燥、称量,电极增重5.4g。已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请按要求回答下列问题:
(1)A电极为电解池的_____极,B电极上产生的气体为_________。
(2)电解前AgNO3溶液的物质的量浓度为____________。
(3)当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为
mol。
(4)铅蓄电池放电时,负极质量______,正极质量_________,电解液的pH_____(填“增大”、“减小”或“不变”)。
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答: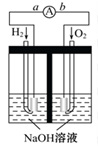
(1)氢氧燃料电池的能量转化形式主要是______,在导线中电子流动方向为______(用a、b表示)。
(2)负极反应式为__________________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: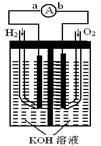
⑴氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为 (用a、b 表示)。
⑵负极反应式为 。
⑶电极表面镀铂粉的原因为 。
⑷该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ. 2Li + H2
Ⅰ. 2Li + H2  2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
(11)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: 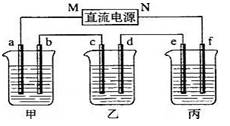
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ; 乙溶液 ; 丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l);ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ (填“>”、“<”或“=”)。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示,a、b两个电极均由多孔的碳块组成。它是将 能转化为 能的装置。
航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2 = 2H2O ,酸式氢燃料电池的电解质是酸、其负极反应为:2H2-4e-= 4H+,则正极反应为 ;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-= 4OH-,则负极反应为: 。
(共8分)新型高能钠硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS Na2Sx。
Na2Sx。
(1)放电时Na发生________反应(填:氧化或还原),S作________极
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为_______________________;
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点。试回答下列问题:
(1)图中通过负载(负载是指用电器)的电子流动方向 (填“向左”或“向右”),负极发生 反应。
(2)写出氢氧燃料电池工作时的电极反应式负极: ,正极: ,
(3)电池工作时,负极区的PH值 (填“增大”或“不变”或“减小”)。