氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。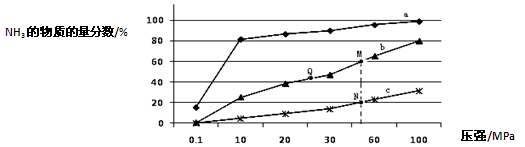
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量3mol,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理: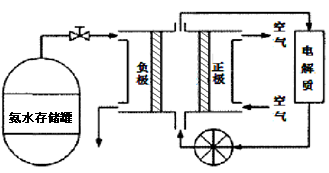
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
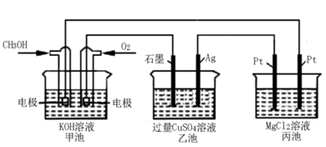
燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有: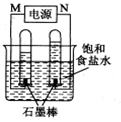
①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则: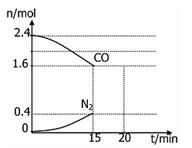
①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
(14 分)碳及其化合物应用广泛。
I.工业上利用CO和水在沸石分子筛表面反应制氢气,CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向 1L恒容密闭容器中注入CO和H2O(g),830oC时,测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO)/mol |
0.200 |
0.160 |
0.125 |
0.099 |
0.080 |
0.080 |
| n(H2O)/mol |
0.300 |
0.260 |
0.225 |
0.199 |
0.180 |
0.180 |
则该温度下反应的平衡常数K=
(2)相同条件下,向 1L恒容密闭容器中,同时注入1molCO、1molH2O(g)、2molCO2和2molH2,此时
v(正) v(逆)(填“>”“=”或“<”)
II.已知:CO(g)+1/2O2(g)=CO2(g) △H1=-141kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ·mol-1
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-726kJ·mol-1
(3)利用CO、H2化合制得液态甲醇的热化学方程式为
Ⅲ.一种新型氢氧燃料电池工作原理如下图所示。
(4)写出电极A的电极反应式 ,放电过程中,溶液中的CO32-将移向电极 (填A或B)
(5)以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
(13分)(1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g) 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
①该反应的平衡常数表达式为K=___。升高温度,平衡常数将____(填“增大”“减小”或“不变”)。
②能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c(C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为 ,则
,则 __________
__________ ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____(填物质名称),其质量约为_______g。
二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池,具有很好的发展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为:____________。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:
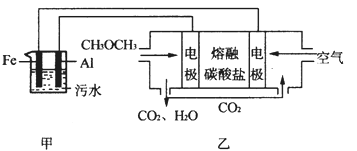
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式__________________;下列物质可用做电池熔融碳酸盐的是______。
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式____________________。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)= ___________。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是______
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)  H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)  H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l) 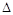 H= 。(请用含有
H= 。(请用含有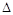 H1、
H1、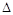 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量(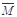 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。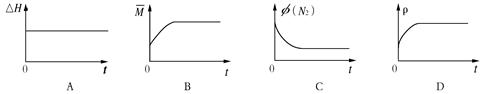
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为 g(假设溶液电解前后体积不变)。
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: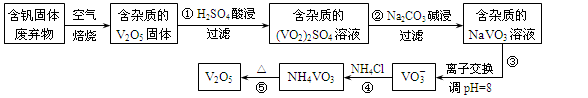
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有 。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。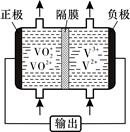
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+2+H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g) 2CO2(g)+S(l)△H=-270kJ∙mol-1
2CO2(g)+S(l)△H=-270kJ∙mol-1
其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择 为该反应的催化剂较为合理。(选填序号)
a.Cr2O3 b.NiO c.Fe2O3
选择该催化剂的理由是: 。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图2)。则图2中表示n(CO) : n(SO2)=3:1的变化曲线为 。
(2)科研小组研究利用铁屑除去地下水中NO3-的反应原理。
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图3(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前发生反应的离子方程式 ;t1时刻后,反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有明显变化,可能的原因是 。
②若在①的反应中加入活性炭,可以提高除去NO3-的效果,其原因可能是 。正常地下水中含有CO32-,会影响效果,其原因有:a.生成FeCO3沉淀覆盖在反应物的表面,阻止了反应的进行;b. 。
(3)LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为 。
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时电池正极反应为 。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
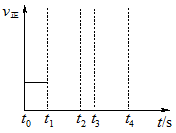
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
 温度/℃ 温度/℃化合物 |
0 |
20 |
40 |
60 |
80 |
100 |
| NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
| ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等。对汽车尾气的治理使环境工作者面临了巨大的挑战。试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是____________________;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=______(用含Ka、Kh的代数式表示),此时溶液的温度______25℃(“>”、“<”、“=”)。
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)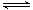 CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
(4)化工上还可以利用CH3OH生成CH3OCH3。在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)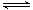 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH |
CH3OCH3 |
H2O |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
207 |
0.20 |
0.090 |
0.090 |
该反应的正反应为________反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向_____方向进行(填“正”、“逆”)。
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用。已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如右图所示: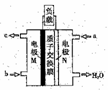
质子穿过交换膜移向_____电极区(填“M”、“N”),负极的电极反应式为________。
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·molˉ1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若2molCH4还原NO2至N2,整个过程中放出的热量为1734kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g) ΔH>0
2Fe(s)+3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g)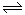 CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。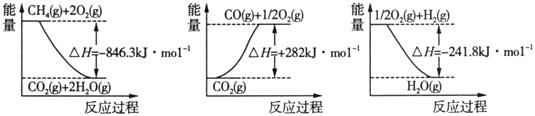
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为______________________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 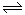 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答: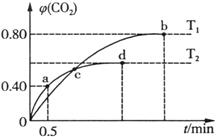
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是___________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
(14分)I.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1="a" kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H2="b" kJ/mol
2CO(g)+O2(g) =2CO2(g) △H3="c" kJ/mol
(1)求反应CH4(g)+CO2(g) =2CO(g)+2H2(g) △H= kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为 。
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2(g)+CH4(g) =CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
①250~300℃时,乙酸的生成速率降低的原因是 。
②300~400℃时,乙酸的生成速率升高的原因是 。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX  2Na+xS (3<x<5)
2Na+xS (3<x<5)

(4)根据上表数据,判断该电池工作的适宜温度应为 (填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是 (填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为 mol,两极的反应物的质量差为 g。(假设电解前两极的反应物的质量相等)