(10分)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
⑴用化学符号表示下列4种微粒:
A:__________;B:__________;C:__________;D:_______。
⑵写出A、B、E三种微粒反应的离子方程式:__________________。
下表是元素周期表的一部分,回答下列有关问题: 1
1
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。(均用元素符号表示)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。(均写出物质的化学式)
X、Y、Z、T为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数Y<Z<X<T,则
(1)元素符号X Y Z T ;
(2)写出X的最高价氧化物对应水化物与Z的最高价氧化物对应水化物反应的离子方程式 ;
(3)按碱性减弱酸性增强的顺序,写出各元素最高价氧化物对应水化物的化学式为
A、B、C、D、E五种元素在周期表里的位置如下表所示:A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。
| |
A |
|
| D |
B |
E |
| |
C |
|
(15分) 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
|
|
|||||||||||||||
| b |
|
|
|
c |
d |
e |
f |
|
|||||||||
| g |
h |
i |
j |
|
k |
l |
m |
||||||||||
| n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为 。
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。
(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为 ,d原子的杂化类型为 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为______ _g/cm3 (用字母表示)。
下表是元素周期表的一部分,回答有关问题。
| |
ⅠА |
ⅡА |
ⅢА |
ⅣА |
ⅤА |
ⅥА |
ⅦА |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
| 4 |
⑩ |
11 |
|
|
|
|
12 |
|
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写) —、最活泼的非金属元素是 、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写) 、碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是 —、原子半径最小的是 (均用元素符号填写)
(4)写出②与④形成化合物的电子式 ;写出①单质的电子式 ;
【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式 。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为 : 。
(14分)W、X、Y、Z是四种常见的短周期元素,其原子序数依次增大,其它相关信息如下表所示
(1 )X位于元素周期表中第________周期第_______族;Y基态原子的电子排布式为_______。
(2) 在W-H、X-H两种共价键中,键的极性较强的是_______,元素Y与W按原子个数比1 : 3形成的化合物所属的晶体类型是_______。
(3) W的一种氢化物(W2H4)与W2X4发生反应: ,反应中若形成
,反应中若形成 键放热103.9k!。则该反应的
键放热103.9k!。则该反应的 =_______。
=_______。
(4) 元素X、Y、Z可形成1:1:1型化合物A,已知A在热的碱性溶液中分解得到物质的量之比为1 : 2的两种盐,写出该反应的化学方程式_______。

 已知短周期元素T、 Q、R、W在元素周期表中的位置如表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
已知短周期元素T、 Q、R、W在元素周期表中的位置如表所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| |
Q |
R |
|
| T |
|
|
W |
 (1)T的原子结构示意图为 。
(1)T的原子结构示意图为 。 (2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):W Q(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。 (4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是 。
(4)已知原子序数比R多1的元素,其一种氢化物能分解为它的另一种氢化物,此分解反应的化学方是 。 (5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。
(5)已知R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式的是 。
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| |
X |
Y |
Z |
M |
R |
Q |
| 原子半径/nm |
|
|
0.186 |
0.074 |
0.099 |
0.143 |
| 主要化合价 |
|
-4,+4 |
|
-2 |
-1,+7 |
+3 |
| 其它 |
阳离子核外无电子 |
无机非金属材料的主角 |
焰色反应呈黄色 |
|
|
|
⑴Y在元素周期表中的位置是 ;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为 。
⑵Q的最高价氧化物与Z的最高价氧化物对应的水化物反应的离子方程式是 。
⑶Y与R相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态 B.稳定性XR >YX4
C.Y与R形成的化合物中Y呈正价
⑷根据表中数据推测,Y的原子半径的最小范围是 nm>r(Y)> nm 。
⑸请用电子式表示Z2M的形成过程 。
元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)上表中与A属于同一周期的元素是 (填元素名称),写出D离子结构示意图 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
已知X、Y、Z、T四种元素中,只有T不是短周期元素,与它们有关部分信息如下表:
(1)Y元素位于周期表的第 周期 族;写出T基态原子电子排布式: 。
(2)X元素单质分子中含有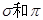 键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
(3)对Z元素的单质或化合物描述一定正确的是 。
a.单质不溶于任何溶剂 b.其最高价氧化物的水化物为弱酸
c.其最高价氧化物常温下为气态d.气态氢化物不稳定
(4)上述四种元素中,其最高价氧化物的水化物呈两性的物质是 (填化学式),试用电离方程式表示其两性的原因 。
(5)已知:①4XH3(g)+5O2(g)=4XO(g)+6H2O(g) △H=-905kJ/mol
②4XH3(g)+3O2(g)=2X2(g)+6H2O(g) △H=-1268kJ/mol
写出X2与O2反应生成XO的热化学方程式 。
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是 。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C在一定条件下反应生成A的化学方程式是 。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH<7,其原因是(写出离子方程式) 。
已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体。
各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)单质B的组成元素在周期表中的位置是 。
(2)丁的电子式为 。
(3)反应①的化学方程式为 。
(4)丁的燃烧产物对环境无污染。丁—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入丁的电极反应式是:
,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(5)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
。
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: 。(精确到小数点后三位)
(17分)
A、B、C、D、E是位于前三周期的五种元素,原子序数依次增大,其中B与D为同一主族元素,它们可形成化合物DB2、DB3。在同周期元素中,C的金属性最强,E的非金属性最强。请回答:
(1)E的原子结构示意图为。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为,该化合物与DB2化合生成一种强酸的化学方程式为。
(3)已知在一定条件下1 mol气态DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是,工业上进行这一反应的设备是。
(4)用铂做电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是。工业中实际常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的 (填“阴”或“阳”)极。